摘要:现有KBr.AgNO3.CuCl2.NaOH四种溶液.置于A.B.C.D四支试管中.进行下列实验: ⑴把A和B中的溶液混合.产生蓝色沉淀 ⑵把A和D中的溶液混合.产生白色沉淀 ⑶把C和D中的溶液混合.产生浅黄色沉淀 由上述现象判断A.B.C.D四支试管中盛放的溶液分别是 . . . .有关的离子方程式 . . .
网址:http://m.1010jiajiao.com/timu3_id_147616[举报]
现有KBr和KCl的混合物3.87g,溶于水并加入过量的AgNO3溶液,产生6.63g沉淀,则混合物中K+的质量分数约为( )。
A.40.3% B.25.9%
C.24.1% D.21.7% 查看习题详情和答案>>
A.40.3% B.25.9%
C.24.1% D.21.7% 查看习题详情和答案>>
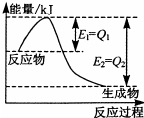 运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.
运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.(1)放热反应2SO2(g)+O2(g)=2SO3(g)是硫酸工业上的重要反应,在体积不变的条件下,下列措施有利于提高SO2平衡转化率的有
A、升高温度 B、降低温度 C、减小压强 D、加入催化剂 E.移出氧气
(2)氮是大气中含量最多的一种元素,氮及其化合物在工农业生产、生活中有着重要应用.用CH4将氮氧化物(用NOx表示)催化还原为N2可以消除氮氧化物带来的污染,该反应的化学方程式为
(3)如图是一定的温度和压强下,N2和H2反应生成1mol NH3过程中的能量变化图,请写出工业合成氨的热化学方程式
(4)在25℃下,将xmol/L的氨水与y mol/L的盐酸等体积混合,反应后溶液显中性,则c(NH4+ )
(5)已知:25℃时,Ksp(AgCl)=1.8×10-10、Ksp(AgBr)=4.9×10 -13.现在向0.001mol/L KBr和0.01mol/L KCl混合溶液中滴加0.1mol/L AgNO3溶液(反应过程中溶液体积变化忽略不计),当出现AgCl沉淀时.c(Br-)=
已知某些化合物的溶度积常数见下表:
现有某种KNO3溶液,欲除去其中混有的少量KBr和Ca(H2PO4)2杂质,可供选择的试剂有:①AgNO3,②K2CO3,③KOH,④HNO3.若规定不得重复使用试剂,且最后溶液中只允许含有K+、NO3ˉ和少量H+、OHˉ,则加入试剂顺序正确的是(过滤步骤除外)( )
查看习题详情和答案>>
| 化学式 | Ksp | 化学式 | Ksp |
| AgBr | 5.0×10-13 | Ag2CO3 | 8.1×10-12 |
| Ag3PO4 | 1.4×10-16 | CaCO3 | 2.8×10-9 |
| AgOH | 2.0×10-8 | Ca3(PO4)2 | 2.0×10-29 |