摘要:( )实验室用MnO2和浓盐酸制氯气时.有14.6 g HCl被氧化.所得氯气全部用石灰乳吸收.可制得漂白精的质量是 A.14.3g B.25.4g C. 28.6g D.50.8g
网址:http://m.1010jiajiao.com/timu3_id_147615[举报]
实验室用MnO2和浓盐酸制氯气时,有14实验室用MnO2和浓盐酸制氯气时,有14.6g氯化氢被氧化,所得氯气全部用石灰乳吸收,可制得漂粉精的质量是
- A.14.3g
- B.25.4g
- C.28.6g
- D.50.8g
实验室用浓盐酸配制250mL0.1mol/L的盐酸溶液:☆
Ⅰ.(1)配制250mL0.1mol/L盐酸溶液需要浓盐酸(密度为1.2g/mL,质量分数为36.5%)的体积为
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)配制物质的量浓度的溶液,造成浓度偏高的操作是
A.溶解后的溶液未冷至室温就转入容量瓶中;
B.洗涤烧杯和玻棒的溶液未转入容量瓶中;
C.定容时眼睛俯视刻度线;
D.定容时眼睛仰视刻度线;
Ⅱ.(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:

①写出甲中发生反应的离子方程式:
②乙中盛的试剂是
丙中盛的试剂是
(2)如果将过量二氧化锰与20mL该浓盐酸混合加热,充分反应后理论上可生成标况下的氯气的体积为
①
(3)若将制得的少量氯气通入无色的饱和碘化钾溶液中,溶液变
(4)若将制得的氯气制成饱和氯水,则实验室保存饱和氯水的方法是
查看习题详情和答案>>
Ⅰ.(1)配制250mL0.1mol/L盐酸溶液需要浓盐酸(密度为1.2g/mL,质量分数为36.5%)的体积为
2.1mL
2.1mL
.(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)
BCAFED
BCAFED
.A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)配制物质的量浓度的溶液,造成浓度偏高的操作是
AC
AC
.A.溶解后的溶液未冷至室温就转入容量瓶中;
B.洗涤烧杯和玻棒的溶液未转入容量瓶中;
C.定容时眼睛俯视刻度线;
D.定容时眼睛仰视刻度线;
Ⅱ.(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:

①写出甲中发生反应的离子方程式:
MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
②乙中盛的试剂是
饱和NaCl溶液
饱和NaCl溶液
;作用是除去Cl2中混有的HCl气体
除去Cl2中混有的HCl气体
.丙中盛的试剂是
浓硫酸
浓硫酸
.(2)如果将过量二氧化锰与20mL该浓盐酸混合加热,充分反应后理论上可生成标况下的氯气的体积为
1344
1344
mL,而实际值明显少于理论值,其主要原因有:①
部分浓盐酸挥发了
部分浓盐酸挥发了
;②随着反应的进行浓盐酸变稀,稀盐酸不能被氧化成氯气
随着反应的进行浓盐酸变稀,稀盐酸不能被氧化成氯气
.(3)若将制得的少量氯气通入无色的饱和碘化钾溶液中,溶液变
棕黄色
棕黄色
色,其离子方程式是Cl2+2I-=2Cl-+I2
Cl2+2I-=2Cl-+I2
,向所得溶液中加入四氯化碳,振荡后静置,则溶液分为两层,下层是显紫红色
紫红色
色,这种操作叫做萃取
萃取
.(4)若将制得的氯气制成饱和氯水,则实验室保存饱和氯水的方法是
保存在细口棕色试剂瓶中,放置冷暗处
保存在细口棕色试剂瓶中,放置冷暗处
.实验室用加热二氧化锰与浓盐酸的混合物制备氯气:
MnO2+4HCl(浓)一套完整的氯气实验室制备装置应该由四部分构成
(如图).同学们需要注意实验仪器的连接和作用.
A.分液漏斗:用来盛放液体试剂,本实验用来盛装浓盐酸.
B.圆底烧瓶:做反应容器,内放固体物质,本实验盛装的是固体二氧化锰.在加浓盐酸时要注意液体的量不能超过烧瓶容积的________,而且加热时要________,使烧瓶底部均匀受热,避免受热不均而炸裂.
C.除杂装置:第一个洗气瓶内盛有饱和食盐水,它的作用是除去氯气中混有的氯化氢杂质;第二个洗气瓶内盛有浓硫酸,用于除去氯气中混有的水蒸气.洗气瓶中两个导管的插入原则是“长进短出”.除杂的顺序是先除氯化氢,后除水蒸气.如果顺序颠倒,不能起到除杂的作用,原因是________.
D.集气装置:用来收集密度比空气大的气体要用向上排空气法.如果不需要收集干燥的氯气,也可以使用________的方法.
E.尾气吸收:因为氯气有毒,会污染环境,多余的氯气不能排放到大气中,选用________进行尾气处理.
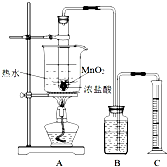 实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.
实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.方法一:
甲同学利用图装置,测定盐酸浓度降至临界浓度时 反应生成氯气的体积,来探究在某温度下浓盐酸与二氧化锰反应的临界浓度.
方法:A中试管有足量的MnO2,往其中加入10mol/L的浓盐酸,控制温度为80℃进行反应.甲同学进行了三次同样的实验,收集气体(体积均换算成标准状况),数据如下表:
| 第一次实验 | 第二次实验 | 第三次实验 | |
| 盐酸的用量 | 10.0mL | 10.0mL | 10.0mL |
| 氯气的体积 | 225mL | 192mL | 223mL |
(1)请写出A中试管内反应的离子方程式
(2)检验该装置的气密性的方法是
(3)B中加入的溶液为
(4)为计算与二氧化锰反应的浓盐酸临界浓度,甲同学的第
方法二:
(5)乙同学认为该实验有不足之处:浓盐酸易挥发,会造成上述所测的临界浓度
乙同学提出可直接用反应后A中的溶液来测定盐酸的临界浓度:
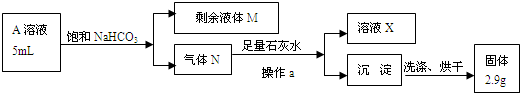
(6)以上图表中操作a的名称是
(7)请写出A溶液中的物质与NaHCO3溶液反应的离子方程式:
(8)根据以上数据,浓盐酸与二氧化锰制氯气的反应中浓盐酸的临界浓度为