摘要:6.下列反应盐酸作还原剂的是( ) A.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O B.CaCO3+2HClCaCl2+CO2↑+H2O C.2HCl+ZnZnCl2+H2↑ D.2KMnO4+16HCl2KCl+2MnCl2+5Cl2↑+8H2O
网址:http://m.1010jiajiao.com/timu3_id_147233[举报]
|
下列反应中盐酸作还原剂的是 | |
A. |
MnO2+4HCl(浓) |
B. |
CaCO3+2HCl |
C. |
2HCl+Zn |
D. |
2KMnO4+16HCl |
|
下列反应中盐酸作还原剂的是 | |
| [ ] | |
A. |
NaOH+HCl |
B. |
Zn+2HCl |
C. |
MnO2+4HCl(浓) |
D. |
CuO+2HCl |
|
下列属于氧化还原反应且盐酸作为氧化剂的是 | |
| [ ] | |
A. |
Zn+2HCl |
B. |
CaCO3+2HCl |
C. |
MnO2+4HCl(浓) |
D. |
Ca(ClO)2+2HCl |
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
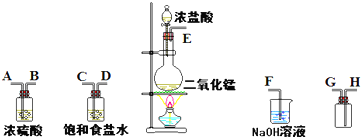
(1)连接上述仪器的正确顺序(填各接口处的字母):
(2)装置中,饱和食盐水的作用是
(3)化学实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生.如果有Cl2产生,可观察到
(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应:
②NaOH溶液中发生的反应:
(5)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O.
①标出该反应电子转移的方向和数目
②氧化剂和还原剂的物质的量之比为
③当有0.2mole-转移时被氧化的HCl的质量是
④如果将20ml 12mol?L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将
A.≥1.68L B.>1.68L C.≤1.68L D.<1.68L.
查看习题详情和答案>>

(1)连接上述仪器的正确顺序(填各接口处的字母):
E
E
接C
C
;D
D
接A
A
;B
B
接H
H
;G
G
接F
F
.(2)装置中,饱和食盐水的作用是
除去氯气中的HCl杂质
除去氯气中的HCl杂质
;NaOH溶液的作用是吸收过量的氯气
吸收过量的氯气
.(3)化学实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生.如果有Cl2产生,可观察到
试纸变蓝
试纸变蓝
,反应方程式2KI+Cl2═2KCl+I2
2KI+Cl2═2KCl+I2
.(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应:
MnO2+4HCl(浓)
MnCl2+Cl2+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2+2H2O
| ||
②NaOH溶液中发生的反应:
2NaOH+Cl2═NaCl+NaClO+H2O
2NaOH+Cl2═NaCl+NaClO+H2O
(5)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O.
①标出该反应电子转移的方向和数目
②氧化剂和还原剂的物质的量之比为
1:5
1:5
;③当有0.2mole-转移时被氧化的HCl的质量是
7.3g
7.3g
;该反应中被氧化和未被氧化的盐酸的物质的量之比是5:3
5:3
,④如果将20ml 12mol?L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将
D
D
.A.≥1.68L B.>1.68L C.≤1.68L D.<1.68L.
已知单质硫是淡黄色固体粉末,难溶于水。实验室制氯气的反应原理为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
 MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: 
(1)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-还原性强;④HCl比H2S稳定;⑤硫原子与氯原子电子层数相同,氯原子半径小于硫原子。可作为氯元素比硫元素非金属性强的依据的是______________ 。
A.②④ B.②③④⑤ C.②④⑤ D.全部
(2)装有饱和食盐水的洗气瓶的作用是 ______________
(3)装置B中盛放的试剂是______________(填选项),实验现象为____________ 。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)装置B中的溶液在实验后质量增重了0.78g,则在B中反应的气体为___________mol
(5)装置C中盛放烧碱稀溶液,目的是吸收剩余气体,防止污染空气。写出反应的离子方程式:____________________。
查看习题详情和答案>>
A.②④ B.②③④⑤ C.②④⑤ D.全部
(2)装有饱和食盐水的洗气瓶的作用是 ______________
(3)装置B中盛放的试剂是______________(填选项),实验现象为____________ 。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)装置B中的溶液在实验后质量增重了0.78g,则在B中反应的气体为___________mol
(5)装置C中盛放烧碱稀溶液,目的是吸收剩余气体,防止污染空气。写出反应的离子方程式:____________________。