网址:http://m.1010jiajiao.com/timu3_id_146874[举报]
垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃含有铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。其实验方案如下:
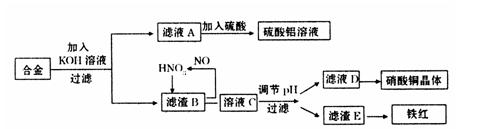
(1)请写出在合金中加入KOH溶液后所发生的离子反应方程式:
。
(2)在滤液A中直接加入硫酸所获得的硫酸铝溶液中会含有杂质(K2SO4),请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液。仿照上图形式画出制备流程图:(提示:在箭头上下方标出所用试剂或实验操作)

(3)已知Fe(OH)3沉淀的pH是2~3.2。溶液C通过调节pH可以使Fe3+沉淀完全。下列物
质中,可用作调整溶液C的pH的试剂是 (填序号)
A. 铜粉 B.氨水 C. 氧化铜 D.氢氧化铜
(4)利用滤液D制取硝酸铜晶体,必须进行的实验操作步骤:加热蒸发、冷却结晶、
(填操作名称)、自然干燥。
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol·L-1,c(H2SO4)=3mol·L-1。将0.3mol的铜放入并充分反应后,产生的铜盐的化学式是 ,被还原的n(HNO3)= 。
查看习题详情和答案>>垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃含有铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。其实验方案如下:
(1)请写出在合金中加入KOH溶液后所发生的离子反应方程式:
。
(2)在滤液A中直接加入硫酸所获得的硫酸铝溶液中会含有杂质(K2SO4),请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液。仿照上图形式画出制备流程图:(提示:在箭头上下方标出所用试剂或实验操作)
(3)已知Fe(OH)3沉淀的pH是2~3.2。溶液C通过调节pH可以使Fe3+沉淀完全。下列物
质中,可用作调整溶液C的pH的试剂是 (填序号)
A. 铜粉 B.氨水 C. 氧化铜 D.氢氧化铜
(4)利用滤液D制取硝酸铜晶体,必须进行的实验操作步骤:加热蒸发、冷却结晶、
(填操作名称)、自然干燥。
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol·L-1,c(H2SO4)=3mol·L-1。将0.3mol的铜放入并充分反应后,产生的铜盐的化学式是 ,被还原的n(HNO3)= 。
查看习题详情和答案>>
垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃含有铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。其实验方案如下:
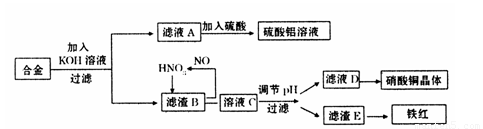
(1)请写出在合金中加入KOH溶液后所发生的离子反应方程式:
。
(2)在滤液A中直接加入硫酸所获得的硫酸铝溶液中会含有杂质(K2SO4),请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液。仿照上图形式画出制备流程图:(提示:在箭头上下方标出所用试剂或实验操作)
(3)已知Fe(OH)3沉淀的pH是2~3.2。溶液C通过调节pH可以使Fe3+沉淀完全。下列物
质中,可用作调整溶液C的pH的试剂是 (填序号)
A. 铜粉 B.氨水 C. 氧化铜 D.氢氧化铜
(4)利用滤液D制取硝酸铜晶体,必须进行的实验操作步骤:加热蒸发、冷却结晶、
(填操作名称)、自然干燥。
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol·L-1,c(H2SO4)=3mol·L-1。将0.3mol的铜放入并充分反应后,产生的铜盐的化学式是 ,被还原的n(HNO3)= 。
查看习题详情和答案>>
垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃含有铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。其实验方案如下:
 (1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:
(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:
写出滤渣B中发生反应的离子方程式:
(2)已知Fe(OH)3沉淀的pH是2~3.2,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中,可用作调整溶液C的pH的试剂是 (填序号)
A.铜粉 B.氨水 C.氧化铜 D.氢氧化铜
(3)利用滤液D制取硝酸铜晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、
(填操作名称)、自然干燥。
(4)选用提供的试剂,设计实验验证铁红中是否含有FeO。
提供的试剂:a.稀盐酸 b.稀硫酸 c.KSCN溶液 d.KMnO4溶液 e.NaOH溶液 f.碘水
所选用的试剂为 (填序号);证明铁红中含有FeO的实验现象为 。
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol·L-1,c(H2SO4)=3mol·L-1,将0.3mol的铜放入并充分反应后,被还原的HNO3的物质的量为 。
查看习题详情和答案>>(2)王同学想在钥匙上镀上一层铜,设计电解实验时,钥匙应和电源的
(3)碳作阳极,铜作阴极电解MgCl2溶液的离子方程式:
(4)用惰性电极电解饱和食盐水,当电源供给0.2mol电子时,停止通电.若此时溶液体积为2L,则所得电解液的pH是
(5)将含有0.4mol Cu(NO3)2和0.4mol KCl的溶液1L,用铂电极电解一段时间后,在一个极析出0.3mol红色物质,则另一个极上放出气体(标准状况下)为