摘要:⒈在1-18号元素组成的化合物中具有三核10个电子的共价化合物是 ,具有三核20个电子的离子化合物是 . ⒉某元素的气态氢化物HXR在某温度下分解为氢气和固体物质.在相同条件下体积为原来的1.5倍.分解前后气体的密度比为17:1.该元素原子核内中子数与质子数之差为1.该元素的符号为 .R原子核内中子数为 .R原子的电子排布式为 .R原子的最高氧化物的分子式为 .其溶于水后生成物为 . ⒊由氨水和次氯酸盐溶液在弱碱性介质中反应可生成氯胺H2NCl.分子结构类似于NH3.H2NCl分子的空间构型为 .电子式为 .H2NCl中的氯的氧化数为 . ⒋近几十年发展起来的关于超重元素核稳定性理论认为:当原子核中质子和中子数目达到某一“幻数 时.这个核将是特别稳定的.在周期表中铀以前的元素中具有2.8.20.28.50.82个质子或中子的核是特别稳定的.中子数126也是一个重要的幻数.氦.氧.钙.铅的质子数和中子数都是幻数.具有这种双幻数的原子核更为稳定.科学家们用计算机算出下一个具有双幻数的元素将是含114个质子和184个中子的第114号元素X.若已知原子结构规律不发生变化.该元素X就是第 周期第 族元素.其最高氧化物的分子式为 .再下一个具有双幻数的超重元素是质子数为164.中子数为318的164号元素Y.它应是第 周期第 族元素.
网址:http://m.1010jiajiao.com/timu3_id_146589[举报]
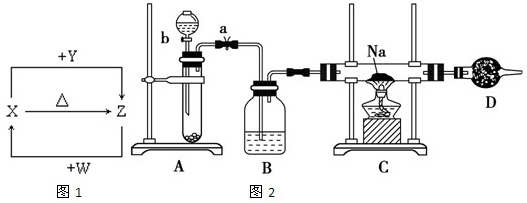
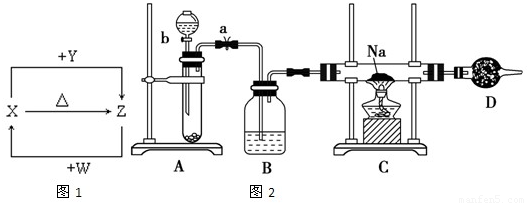
X、Y、Z、W四种化合物均由1~18号元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有下列转化关系如图1(部分反应物、产物及反应条件已略去).请回答:
(1)W的分子式是
(2)X与Y在溶液中反应的离子方程式是
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用图2装置快速制取少量的O2,并演示Na在O2中的燃烧实验.
①关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管.试判断装置是否漏气
②写出A装置中反应的化学方程式并标出电子得失情况:
 .
.
③C装置中观察到的现象是
④D装置中盛放的试剂是
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是

查看习题详情和答案>>
(1)W的分子式是
CO2
CO2
.(2)X与Y在溶液中反应的离子方程式是
HCO3-+OH-=CO32-+H2O
HCO3-+OH-=CO32-+H2O
.(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用图2装置快速制取少量的O2,并演示Na在O2中的燃烧实验.
①关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管.试判断装置是否漏气
漏气
漏气
(填“漏气”、“不漏气”或“无法确定”),判断理由是漏斗中的液体能全部流入试管说明试管中压强与外界相同
漏斗中的液体能全部流入试管说明试管中压强与外界相同
.②写出A装置中反应的化学方程式并标出电子得失情况:


③C装置中观察到的现象是
剧烈燃烧,发出黄光,有淡黄色物质生成;
剧烈燃烧,发出黄光,有淡黄色物质生成;
.④D装置中盛放的试剂是
碱石灰
碱石灰
,其作用是防止空气中的H2O、CO2进入C装置
防止空气中的H2O、CO2进入C装置
.(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是
2Na2CO3+Cl2+H2O=NaClO+NaCl+2NaHCO3
2Na2CO3+Cl2+H2O=NaClO+NaCl+2NaHCO3
.
X、Y、Z、W四种化合物均由1~18号元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有下列转化关系如图1(部分反应物、产物及反应条件已略去).请回答:
(1)W的分子式是______.
(2)X与Y在溶液中反应的离子方程式是______.
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用图2装置快速制取少量的O2,并演示Na在O2中的燃烧实验.
①关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管.试判断装置是否漏气______ (填“漏气”、“不漏气”或“无法确定”),判断理由是______.
②写出A装置中反应的化学方程式并标出电子得失情况:______.
③C装置中观察到的现象是______.
④D装置中盛放的试剂是______,其作用是______.
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是______.

查看习题详情和答案>>
X、Y、Z、W四种化合物均由1~18号元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有下列转化关系如图1(部分反应物、产物及反应条件已略去).请回答:
(1)W的分子式是______.
(2)X与Y在溶液中反应的离子方程式是______.
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用图2装置快速制取少量的O2,并演示Na在O2中的燃烧实验.
①关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管.试判断装置是否漏气______ (填“漏气”、“不漏气”或“无法确定”),判断理由是______.
②写出A装置中反应的化学方程式并标出电子得失情况:______.
③C装置中观察到的现象是______.
④D装置中盛放的试剂是______,其作用是______.
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是______.
查看习题详情和答案>>
(1)W的分子式是______.
(2)X与Y在溶液中反应的离子方程式是______.
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用图2装置快速制取少量的O2,并演示Na在O2中的燃烧实验.
①关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管.试判断装置是否漏气______ (填“漏气”、“不漏气”或“无法确定”),判断理由是______.
②写出A装置中反应的化学方程式并标出电子得失情况:______.
③C装置中观察到的现象是______.
④D装置中盛放的试剂是______,其作用是______.
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是______.

X、Y、Z、W四种化合物均由1~18号元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有下列转化关系如图1(部分反应物、产物及反应条件已略去).请回答:
(1)W的分子式是______.
(2)X与Y在溶液中反应的离子方程式是______.
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用图2装置快速制取少量的O2,并演示Na在O2中的燃烧实验.
①关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管.试判断装置是否漏气______ (填“漏气”、“不漏气”或“无法确定”),判断理由是______.
②写出A装置中反应的化学方程式并标出电子得失情况:______.
③C装置中观察到的现象是______.
④D装置中盛放的试剂是______,其作用是______.
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是______.
查看习题详情和答案>>
(1)W的分子式是______.
(2)X与Y在溶液中反应的离子方程式是______.
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用图2装置快速制取少量的O2,并演示Na在O2中的燃烧实验.
①关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管.试判断装置是否漏气______ (填“漏气”、“不漏气”或“无法确定”),判断理由是______.
②写出A装置中反应的化学方程式并标出电子得失情况:______.
③C装置中观察到的现象是______.
④D装置中盛放的试剂是______,其作用是______.
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是______.

查看习题详情和答案>>
A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.
根据以上信息,回答下列问题:
(1)A和D的氢化物中,沸点较低的是 (填“A”或“D”);
A和D的电负性较大的是 (填“A”或“D”);
B和C的第一电离能较小的是 (填“B”或“C”);
A和B的离子中,半径较小的是 (填离子符号);
元素C的原子核外电子排布式为 ;
C单质的晶体中原子以 键相结合.
(2)写出B、C的最高价氧化物的水化物相互反应的离子方程式: 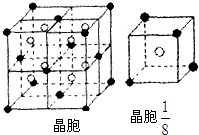
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“●”表示)于该正方体的顶点或面心;阴离子(用“〇”表示)均位于小正方体中心.该化合物的化学式是
(4)已知晶胞
的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算,结果保留一位小数. .
查看习题详情和答案>>
根据以上信息,回答下列问题:
(1)A和D的氢化物中,沸点较低的是
A和D的电负性较大的是
B和C的第一电离能较小的是
A和B的离子中,半径较小的是
元素C的原子核外电子排布式为
C单质的晶体中原子以
(2)写出B、C的最高价氧化物的水化物相互反应的离子方程式:

(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“●”表示)于该正方体的顶点或面心;阴离子(用“〇”表示)均位于小正方体中心.该化合物的化学式是
(4)已知晶胞
| 1 | 8 |