摘要:30.将ag H2与bg Cl2充分混合后.点燃使其充分反应.然后将反应后的混合气用足量的氢氧化钠溶液吸收 (1)写出可能发生的反应的化学方程式: (2)若H2与Cl2恰好充分反应.只生成HCl.则生成NaCl的物质的量为 .或 . (3)若H2过量.则剩余气体质量为 .生成NaCl的质量为 . (4)若Cl2过量.则生成的NaCl的质量为 .
网址:http://m.1010jiajiao.com/timu3_id_146588[举报]
 (1)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
(1)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.4kJ?mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-218.0kJ/mol
CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-218.0kJ/mol
.(2)在压强为0.1MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);CO的转化率与温度、压强的关系如图所示.①该反应的△H
<
<
0(填“<”、“>”或“=”).②在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率
增大
增大
(填“增大”、“减小”或“不变”).(3)实验室中配制AgNO3溶液时通常需要向其中加入
硝酸
硝酸
,目的是抑制Ag+水解
抑制Ag+水解
; AgCl在水中存在沉淀溶解平衡:AgCl(s)═Ag+(aq)+Cl-(aq).25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2mol?L-1AgNO3溶液;③100mL 0.1mol?L-1氯化镁溶液;④100mL 0.1mol?L-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是②①④③
②①④③
(填写序号).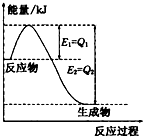 运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.(1)如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):
N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ?mol-1
(2)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定--氨的电解法合成,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2
| ||
| (一定条件) |
阳
阳
极(填“正”、“负”、“阴”或“阳”);在另一电极通入N2,该电极反应式为N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
.(3)氨气溶于水得到氨水.在25℃下,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合(混合后体积为混合前体积之和),反应后溶液显中性.求25℃下该混合溶液中氨水的电离平衡常数
| b×10-7 |
| a-b |
| b×10-7 |
| a-b |
(4)已知:25℃时KSP(AgCl)=1.6×l0-10 KSP(AgI)=1.5×l0-16
海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在.在25℃下,向0.1L0.002mol?L-l的NaCl溶液中逐滴加入适量的0.1L0.002mol?L-l硝酸银溶液,有白色沉淀生成,从难溶电解质的溶解平衡角度解释产生沉淀的原因是
c(Ag+)?c(Cl-)>Ksp(AgCl)
c(Ag+)?c(Cl-)>Ksp(AgCl)
,向反应后的浑浊液中继续加入0.1L0.002mol?L-1的NaI溶液,看到的现象是白色沉淀转化为黄色沉淀
白色沉淀转化为黄色沉淀
,产生该现象的原因是(用离子方程式表示)AgCl(s)+I-(aq)═AgI(s)+Cl-(aq)
AgCl(s)+I-(aq)═AgI(s)+Cl-(aq)
.