网址:http://m.1010jiajiao.com/timu3_id_146456[举报]
 2NO(g)△H>0
2NO(g)△H>0已知该反应在2404℃时,平衡常数K=64×10-4.请回答:
(1)该反应的平衡常数表达式为
| c2(NO) |
| c(N2)?c(O2) |
| c2(NO) |
| c(N2)?c(O2) |
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应
| (3×10-3 )2 |
| (2.5×10-1)×(4.0×10-2) |
| (3×10-3 )2 |
| (2.5×10-1)×(4.0×10-2) |
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是

(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态.与原平衡状态相比,此时平衡混合气中NO的体积分数
①6.8g熔融状态的KHSO4中含有0.1NA个阳离子
②0.5mol?L-1Mg(NO3)2溶液中含有N
| O | - 3 |
③7.8g Na2S和Na2O2的固体混合物中含有的阴离子数大于0.1NA
④2mol SO2和1mol O2混合气体在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA
⑤Fe与0.1mol氯气反应时失去的电子数为0.3NA
⑥含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA.
(12分)汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g)  2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为 。
(2)该温度下,向2L密闭 容器中充入N2和O2各1mol,平衡时,N2的转化率是 %
容器中充入N2和O2各1mol,平衡时,N2的转化率是 %
(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L
和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向
正反应方向进行”或“向逆反应方向进行”),理由是
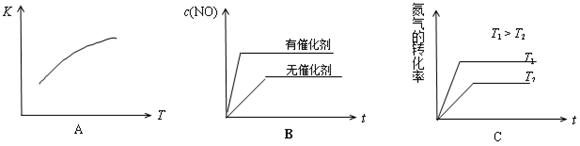
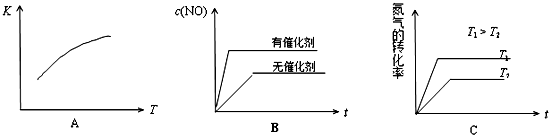
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入
一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的
体积分数 (填“变大、“变小”或“不变”)。
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g)  2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是 %(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L 和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 .
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数 (填“变大、“变小”或“不变)
查看习题详情和答案>>

2NO(g)△H>0
已知该反应在2404℃时,平衡常数K=64×10-4.请回答:
(1)该反应的平衡常数表达式为
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是 %(保留整数).
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 .
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号).
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态.与原平衡状态相比,此时平衡混合气中NO的体积分数 填“变大、“变小”或“不变”).