网址:http://m.1010jiajiao.com/timu3_id_145835[举报]

(1)H2O热分解可以得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示.图1中
A、B表示的粒子依次是
(2)镍氢碱性电池已广泛应用于各种电器的供电,其中LaNi5有良好的储氢能力,其最大储氢量达到6.02
×1022个氢原子/cm3,则每立方厘米LaNi5吸附氢气的体积在标准状况下为
用固体LaNi5H6(各元素的化合价均可看作零)作负极反应物,该镍氢碱性电池放电时,负极电极反应式为
(3)有人设想利用H2实现碳循环,有关反应原理为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ/mol.一定温度下,在容积为1L的密闭容中,冲入1mol CO2和3molH2,测得CO2和 CH3OH(g)的浓度随时间的变化如图2所示.
①前10min CO2的平均反应速率为
②该温度下,此反应的平衡常数为
③为了提高CO2的平衡转化率可采取的措施是
A.升高温度
B.恒温恒容下再充入CO2
C.将CH3OH(g)从体系中分离出来
D.更换催化剂
E.恒温恒容下再充入 1mol CO2和3molH2.
2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8一羟基喹啉铝等.

(1)Mn2+在基态时,核外电子排布式为
(2)硫化锌的晶胞结构如图1所示,则每个晶胞中含S2-的数目为
(3)蒽(
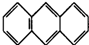 ,平面结构)属于
,平面结构)属于(4)8一羟基喹啉铝具有较高的发光效率.8一羟基喹啉铝的分子结构如图2所示,其分子中存在的相互作用力有
(5)已知铜元素能形成多种化合物.
①CuSO4?5H2O也可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图3所示.下列说法正确的是
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.该晶体中电负性最大的元素是O
C.该晶体属于原子晶体
D.该晶体中的水在不同温度下会分步失去
②YBCO-12也是一种含Cu元素的化合物,化学式为YBa2Cu3O6.95.已知该化合物中各元素的化合价为:Y为+3价、Ba为+2价、O为-2价、Cu为+2价和+3价.则该化合物中+2价Cu和+3价Cu的原子个数之比为
(1)氯原子最外层有
(2)下列可用作比较S和C非金属性强弱依据的是
A.CS2中各元素的化合价
B.气态氢化物的稳定性
C.元素在周期表中的位置
D.最高价含氧酸的酸性
(3)以下性质的比较正确的是
A.键长:HF>HCl
B.稳定性:HF>HCl
C.酸性:HF>HCl
D.沸点:HF>HCl
(4)O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点.O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力.常温常压下发生反应如下:
反应①O3═O2+[O]-Q平衡常数为K1;
反应②[O]+O3═2O2+Q平衡常数为K2;
总反应:2O3═3O2+Q平衡常数为K.
一定条件下,O3的浓度减少一半所需的时间(t)如表所示.已知:O3的起始浓度为0.0216mol/L.在30°C、pH=4.0条件下,O3的分解速率为
| T/℃t/min pH | 3.0 | 4.0 | 5.0 | 6.0 | 20 | 301 | 231 | 169 | 58 | 30 | 158 | 108 | 48 | 15 | 50 | 31 | 26 | 15 | 7 |
A.40°C、pH=3.0
B.10°C、pH=4.0
C.30°C、pH=7.0
(6)下列叙述正确的是
A.降低温度,K增大
B.K=K1+K2
C.适当升温,可提高消毒效率
D.压强增大,K2减小.
阅读资料,获取信息,回答问题。
(A) A、 B、C、D为四种元素,A原子的1S轨道为半充满;在元素周期表中,B的电负性最大;C的原子序数为24;D2+的电子排布式和Ar相同。
(B)两元素电负性差值大于1. 7,原子间一般形成离子键;小于1. 7,原子间一般形成共价键。
(C)下列是周期表中部分元素的电负性x和第一电离能I1 (KJ·mol-1):
(1).A原子的轨道表示式为 ,B原子的价电子排布式为 ,C原子的电
子排布式为 ,D在周期表中的位置为________周期________族。
(2).电负性最小的元素位于 族,第一电离能最大的元素是(填元素符号) ;
锂元素的电负性取值范围为 <x(Li)< ;A12S3属 化合物
(3)标出化合物OF2、 LiAlH4中各元素的化合价(写在元素符号上)。
自然界中的水要经过消毒杀菌才可成为生活饮用水。ClO2是一种高效安全灭菌消毒剂,
其中Cl化合价为 价。
价。
(1)氯原子最外层有 种能量不同的电子,某化合物中O的化合价与ClO2中O的化合价恰好相反,写出该化合物的分子式 。
(2)下列可用作比较S和C非金属性强弱依据的是
A.CS2中各元素的化合价 B.气态氢化物的稳定性
C.元素在周期表中的位置 D.最高价含氧酸的酸性
(3)以下性质的比较正确的是
A.键长:HF>HCl B.稳定性:HF>HCl
C.酸性:HF>HCl D.沸点:HF>HCl
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应① O3 O2
+[O]-Q 平衡常数为K1 ;
O2
+[O]-Q 平衡常数为K1 ;
反应② [O]+O3 2O2+Q 平衡常数为K2 ;
2O2+Q 平衡常数为K2 ;
总反应:2O3 3O2+Q 平衡常数为K。
3O2+Q 平衡常数为K。
(4)一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
已知:O3的起始浓度为0.0216 mol/L。
|
pH t / min T / ℃ |
3.0 |
4.0 |
5.0 |
6.0 |
|
20 |
301 |
231 |
169 |
58 |
|
30 |
158 |
108 |
48 |
15 |
|
50 |
31 |
26 |
15 |
7 |
在30°C、pH=4.0条件下,O3的分解速率为_______________ mol/ (L·min)。
(5)根据表中数据,推测O3在下列条件下分解速率由小到大的顺序为________。(填字母代号)
A.40°C、pH=3.0 B.10°C、pH=4.0 C.30°C、pH=7.0
(6)下列叙述正确的是
A.降低温度,K增大 B.K=K1+K2
C.适当升温,可提高消毒效率 D.压强增大,K2减小
查看习题详情和答案>>