摘要:分析溶液的酸盐性: (1)若题目限定为碱性.不能大量存在的有: a.H+ H++OH-= , b.生成弱碱或不溶碱的阳离子:Fe3+.Al3+.Mg2+.Cu2+.Ag+.NH4+等. Fe3++ OH-= , NH4++OH-= , Al3++ OH-= , c.酸式酸根离子:HCO3-.HSO3-.H2PO4-.HS-等. HCO3-+ OH-= , HS-+OH-= , 高一化学知识小卡片( 06) 班 姓名 知识点:离子共存(一): 判断溶液中离子是否大量共存可以从以下几方面加以具体分析:1.分析溶液的颜色: 若题目限定是无色透明.则溶液中一定无Fe2+.Fe3+.Cu2+.MnO4-等离子.
网址:http://m.1010jiajiao.com/timu3_id_145827[举报]
(2010?卢湾区二模)高锰酸钾在不同的条件下发生还原反应如下:
MnO4-+5e+8H+→Mn2++4H2O
MnO4-+3e+2H2O→MnO2↓+4OH-
MnO4-+e→MnO42-(溶液绿色)
(1)从上述三个半反应中可以看出高锰酸根离子还原产物受到溶液的
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为
(3)将PbO2投入到MnSO4酸性溶液中搅拌溶液变为紫红色.下列说法正确的是
a.氧化性:PbO2>KMnO4 b.还原性:PbO2>KMnO4 c.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量比为3:2.完成下列化学方程式,并标出电子转移的方向和数目.
若生成5.44g单质硫,反应过程中转移的电子数约为
查看习题详情和答案>>
MnO4-+5e+8H+→Mn2++4H2O
MnO4-+3e+2H2O→MnO2↓+4OH-
MnO4-+e→MnO42-(溶液绿色)
(1)从上述三个半反应中可以看出高锰酸根离子还原产物受到溶液的
酸碱性
酸碱性
影响.(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为
MnO4-
MnO4-
→Mn2+
Mn2+
.(3)将PbO2投入到MnSO4酸性溶液中搅拌溶液变为紫红色.下列说法正确的是
a
a
.a.氧化性:PbO2>KMnO4 b.还原性:PbO2>KMnO4 c.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量比为3:2.完成下列化学方程式,并标出电子转移的方向和数目.
28
28
KMnO4+5
5
K2S+24KOH
24KOH
→28
28
K2MnO4+3
3
K2SO4+2
2
S↓+12H2O
12H2O
若生成5.44g单质硫,反应过程中转移的电子数约为
2.38NA
2.38NA
;若反应中有22mol电子转移,则生成K2SO4和S的物质的量比为3:2
3:2
.如图是某具有高效能的高铁电池的实验装置,已知放电后,两极得到铁的相同价态的化合物。
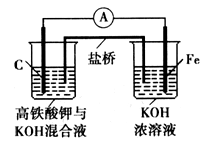
请问答下列问题:
(1)该电池放电时正极发生的电极反应是_________;若该电池属于二次电池,则充电时阴极的电极反应式为_________________
(2)此盐桥中阴离子定向移动的方向是__________;若用某种高分子材料制成隔膜代替盐桥,该隔膜允许通过的离子是____。
(3)高铁酸钾具有极姒的氧化性,是一种优良的水处理剂。请完成FeO42- 与水反应的化学方程式:4FeO42-+10H2O 4Fe(OH)3+8OH-+_______;K2FeO4在处理水的过程中所起的作用是作净水剂和____。
4Fe(OH)3+8OH-+_______;K2FeO4在处理水的过程中所起的作用是作净水剂和____。
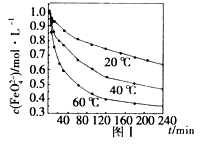
(4)用适量的K2FeO4配制 =1.0 mol·L-1的试液,将试液分别置于20℃、40℃、60℃的恒温水浴中,测出 的变化如图I所示,则(3)中反应的△H_______0(填“>”、“<”或“=”),温度对该反应的反应速率和平衡移动的影响是_______________。
(1)该电池放电时正极发生的电极反应是_________;若该电池属于二次电池,则充电时阴极的电极反应式为_________________
(2)此盐桥中阴离子定向移动的方向是__________;若用某种高分子材料制成隔膜代替盐桥,该隔膜允许通过的离子是____。
(3)高铁酸钾具有极姒的氧化性,是一种优良的水处理剂。请完成FeO42- 与水反应的化学方程式:4FeO42-+10H2O
 4Fe(OH)3+8OH-+_______;K2FeO4在处理水的过程中所起的作用是作净水剂和____。
4Fe(OH)3+8OH-+_______;K2FeO4在处理水的过程中所起的作用是作净水剂和____。 (4)用适量的K2FeO4配制 =1.0 mol·L-1的试液,将试液分别置于20℃、40℃、60℃的恒温水浴中,测出 的变化如图I所示,则(3)中反应的△H_______0(填“>”、“<”或“=”),温度对该反应的反应速率和平衡移动的影响是_______________。
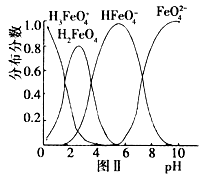
(5) 在水溶液中的存在形态如图Ⅱ所示。下列说法中正确的是___________。
a.无论溶液的酸碱性如何变化,铁元素都有4种存在形态
b.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4- 的分布分数先增大后减小
c.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H2FeO4+OH-=HFeO4-+H2O)
查看习题详情和答案>>
a.无论溶液的酸碱性如何变化,铁元素都有4种存在形态
b.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4- 的分布分数先增大后减小
c.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H2FeO4+OH-=HFeO4-+H2O)
判断盐溶液的酸碱性
(1)强碱弱酸正盐:________发生水解,溶液显________性.
(2)强酸弱碱正盐:________发生水解,溶液显________性.
(3)强酸强碱正盐:不发生水解.
(4)弱酸弱碱正盐:弱酸的阴离子和弱碱的阳离子都发生水解,溶液的酸碱性取决于弱酸和弱碱的相对强弱.
(5)酸式盐:强酸酸式酸根离子只电离不水解,溶液呈酸性;而弱酸的酸式酸根离子既电离又水解,若电离程度大于水解程度,溶液呈酸性,若水解程度大于电离程度,溶液呈碱性.
简言之,“有弱才水解,无弱不水解,都弱都水解;谁弱谁水解,越弱越水解;谁强显谁性,都弱具体定”.
(1)下列盐溶液中能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样,并说明溶液的酸碱性:
K2CO3
K2SO4
NH4Cl
(2)物质的量浓度均为0.1mol/L的下列溶液:①KNO3、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH、⑦Ba(OH)2、⑧NH4Cl,pH由大到小的顺序为:
(3)现有常温下的0.1mol?L-1 Na2CO3溶液:
①你认为该溶液呈碱性的原因是(用离子方程式表示)
②为证明你的上述观点,请设计一个简单的实验,简述实验过程
查看习题详情和答案>>
K2CO3
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
,溶液呈碱
碱
性;K2SO4
不发生水解
不发生水解
,溶液呈中性
中性
性;NH4Cl
NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
,溶液呈酸
酸
性.(2)物质的量浓度均为0.1mol/L的下列溶液:①KNO3、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH、⑦Ba(OH)2、⑧NH4Cl,pH由大到小的顺序为:
⑦>⑥>②>③>①>⑧>⑤>④
⑦>⑥>②>③>①>⑧>⑤>④
(填数字代号)(3)现有常温下的0.1mol?L-1 Na2CO3溶液:
①你认为该溶液呈碱性的原因是(用离子方程式表示)
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
;②为证明你的上述观点,请设计一个简单的实验,简述实验过程
向Na2CO3溶液中加酚酞试液,溶液变红色,说明溶液显碱性,证明Na2CO3水解
向Na2CO3溶液中加酚酞试液,溶液变红色,说明溶液显碱性,证明Na2CO3水解
.(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.
①若HA为HCN,该溶液显碱性,则溶液中c(CN-) c(Na+)(填“<”、“=”或“>”),你得出该结论的依据是 .
②若HA为CH3COOH,该溶液显酸性.溶液中所有的离子按浓度由大到小排列的顺序是 .
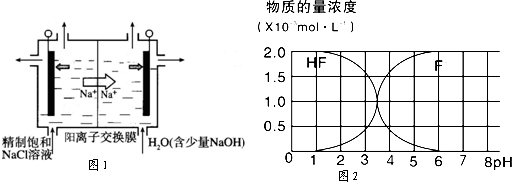
(2)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂,目前已开发出用电解法制取ClO2的新工艺.
①如图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2.写出阳极产生ClO2的电极反应式:
.
②电解一段时间,当阴极产生的气体体积为336mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为 mol;用平衡移动原理解释阴极区pH增大的原因 .
(3)25℃时,2.0×10-3mol?L-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到的(HF)、c(F-)与溶液pH的变化关系如图2.若将4.0×10-4mol?L-1CaCl2溶液与4.0×10-3mol?L-1HF溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF2沉淀析出.[已知Ksp(CaF2):1.5×10-10] .
查看习题详情和答案>>

①若HA为HCN,该溶液显碱性,则溶液中c(CN-)
②若HA为CH3COOH,该溶液显酸性.溶液中所有的离子按浓度由大到小排列的顺序是
(2)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂,目前已开发出用电解法制取ClO2的新工艺.
①如图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2.写出阳极产生ClO2的电极反应式:
②电解一段时间,当阴极产生的气体体积为336mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为
(3)25℃时,2.0×10-3mol?L-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到的(HF)、c(F-)与溶液pH的变化关系如图2.若将4.0×10-4mol?L-1CaCl2溶液与4.0×10-3mol?L-1HF溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF2沉淀析出.[已知Ksp(CaF2):1.5×10-10]