摘要:最外层电子数是电子层数2倍的原子有: , 高一化学知识小卡片( 34) 班 姓名 知识点:1-18号元素原子的结构特征:
网址:http://m.1010jiajiao.com/timu3_id_145798[举报]
 原子序数小于36的x、Y、z、w四种元素,元素x的原子核外最外层电子数是内层电子数的2倍,元素Y与x同周期,其基态原子占据s轨道的电子数与占据p轨道的电子数相同,z是x的同族相邻元素;w是第Ⅷ族元素中原子序数最小的元素.用元素符号回答下列问题:
原子序数小于36的x、Y、z、w四种元素,元素x的原子核外最外层电子数是内层电子数的2倍,元素Y与x同周期,其基态原子占据s轨道的电子数与占据p轨道的电子数相同,z是x的同族相邻元素;w是第Ⅷ族元素中原子序数最小的元素.用元素符号回答下列问题:(1)X、Y、Z的电负性由小到大的顺序是
Si<C<O
Si<C<O
.(2)N3一与x、Y形成的一种化合物互为等电子体,则N3一的空
间构型为
直线型
直线型
、电子式为

(3)同为原子晶体的XY2与ZY2中硬度小的是
SiO2
SiO2
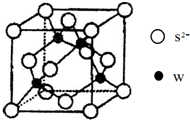
.(4)X和W所形成的某种晶体结构如图所示,写出:
①基态W2+离子的价电子排布式
3d6
3d6
;②该晶体的化学式
FeC
FeC
. 原子序数小于36的X、Y、Z、W四种元素,其中X原子基态时2p原子轨道上有3个未成对电子,Y原子基态时最外层电子数是其内层电子数的3倍,Z元素的最高价氧化物的水化物的酸性最强,W的原子序数为30.
原子序数小于36的X、Y、Z、W四种元素,其中X原子基态时2p原子轨道上有3个未成对电子,Y原子基态时最外层电子数是其内层电子数的3倍,Z元素的最高价氧化物的水化物的酸性最强,W的原子序数为30.(1)元素W的电子排布式为
(2)X、Y与氢元素形成的化合物XH2-YH中采用sp3杂化的原子有
(3)ZO4-离子的空间构型为
(4)元素W的一种硫化物晶体的晶胞结构如右上图所示,该硫化物的化学式是
原子序数逐渐增大的A、B、C、D、E、F六种短周期元素。元素A的单质是密度最小的气体,元素B的单质存在两种以上的同素异形体,且其中一种是自然界中硬度最高的单质,元素D的最外层电子数是次外层电子数的三倍;E、F位于同一周期,该周期内各元素形成的单质沸点变化如上图所示(原子序数按递增顺序连续排列)。
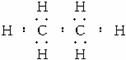
B、C、D、F四种元素均能与A形成等电子的四种分子,且化合物中各原子的个数比如下表:
化合物 | 甲 | 乙 | 丙 | 丁 |
原子个数比 | B∶A=1∶3 | C∶A=1∶2 | D∶A=1∶1 | F∶A=1∶1 |
(1)C的元素符号为___________,元素F在元素周期表中的位置为___________,化合物乙的分子式___________。
(2)丙在一定条件下可生成单质D2;在101 kPa时,0.5 mol D2与A2完全反应生成液态物质放出的热量为285.8 kJ,该反应的热化学方程式为___________。
(3)0.1 mol/L离子化合物EAB2D4溶液呈弱酸性,则溶液中离子浓度的大小顺序为_________________。
(4)化合物甲的电子式为___________,A、B、C、D四种元素中的某三种能形成多种与甲分子等电子的化合物,请写出其中任意一种化合物的分子式___________。
查看习题详情和答案>>