摘要:34.(1)解:杂质质量为l g. CaCO3的质量分数为90%. (2)10.0 g该样品与足量稀盐酸反应后可产生二氧化碳3.96g.(其他合理解题方法参照上述标准计分)
网址:http://m.1010jiajiao.com/timu3_id_1378[举报]
28、下图是小明配制100g溶质质量分数为12%的NaC1溶液的有关实验操作示意图.
(1)请你指出图中一处错误操作,并分析该操作可能造成的后果:
(2)图②、图③表示的操作步骤分别是
(3)配制时需称量氯化钠
查看习题详情和答案>>

(1)请你指出图中一处错误操作,并分析该操作可能造成的后果:
称量时药品与砝码放反,使称量的氯化钠偏少
.(2)图②、图③表示的操作步骤分别是
称量
、溶解
.(3)配制时需称量氯化钠
12
g,如果氯化钠中含有少量不溶的杂质,溶质的质量分数会偏小
(填“偏大”或“偏小”);量取水最好选择③
的量简(填序号①10mL②50mL③100mL).(水的密度为l g/cm3)
下图是小明配制100g溶质质量分数为12%的NaC1溶液的有关实验操作示意图.
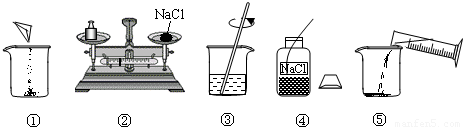
(1)请你指出图中一处错误操作,并分析该操作可能造成的后果:______.
(2)图②、图③表示的操作步骤分别是______、______.
(3)配制时需称量氯化钠______g,如果氯化钠中含有少量不溶的杂质,溶质的质量分数会______(填“偏大”或“偏小”);量取水最好选择______的量简(填序号①10mL②50mL③100mL).(水的密度为l g/cm3)
查看习题详情和答案>>

(1)请你指出图中一处错误操作,并分析该操作可能造成的后果:______.
(2)图②、图③表示的操作步骤分别是______、______.
(3)配制时需称量氯化钠______g,如果氯化钠中含有少量不溶的杂质,溶质的质量分数会______(填“偏大”或“偏小”);量取水最好选择______的量简(填序号①10mL②50mL③100mL).(水的密度为l g/cm3)
查看习题详情和答案>>
下图是小明配制100g溶质质量分数为12%的NaC1溶液的有关实验操作示意图.
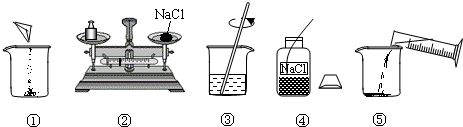
(1)请你指出图中一处错误操作,并分析该操作可能造成的后果:______.
(2)图②、图③表示的操作步骤分别是______、______.
(3)配制时需称量氯化钠______g,如果氯化钠中含有少量不溶的杂质,溶质的质量分数会______(填“偏大”或“偏小”);量取水最好选择______的量简(填序号①10mL②50mL③100mL).(水的密度为l g/cm3)
查看习题详情和答案>>
取只含有少量氯化钠杂质的粉末状纯碱样品11.4 g于烧杯中,逐滴加入稀盐酸至不再产生气体为止,共消耗稀盐酸的质量为50 g,反应后称得烧杯中溶液的质量为57 g(假定反应产生的二氧化碳全部逸出,水蒸气挥发忽略不计).请分析回答下列问题:
(1)题中涉及到的化学反应方程式为________.
(2)运用质量守恒定律,可以算出题中放出二氧化碳的质量为________g.
(3)计算反应后溶液中溶质的质量分数(写出详细的计算过程,数据精确到l%).
学习热情和学习方法是成才的必备条件,灵活掌握不同的学习方法可以取得事半功倍的效果.请用以下方法解决下列问题:
(1)分类法:利用下列4组物质请按要求填写下表横线上(填写物质的化学式或分类标准)(分类标准包括:酸、碱、盐、金属氧化物、非金属氧化物、金属单质、非金属单质)
A.ZnO、MgO、CO2、Na2O B.Cu、N2、C、Cl2
C.KNO3、NaHCO3、KClO3、Fe(OH)3 D.H2SO4、H2O、HCl、HNO3
(2)对比法:
A.通过对CO2+H2O→H2CO3 和 6CO2+6H2O
C6H12O6+6O2两个化学反应的对比,你能得出的结论是:相同的反应物在不同的条件下
B.如图1所示:小海同学将盛有干燥白磷的甲试管和干燥红磷的乙试管插入盛有80℃的烧杯里(甲、乙试管均套有气球密封).过一会后,发现甲试管中的白磷燃烧,乙试管中的红磷没有燃烧.请根据小海同学的实验现象,对比得出可燃物燃烧所需的条件之一:

(3)归纳演绎法:
某同学通过对大量化学反应前后各物质的质量总和的测定分析(如图2中的氢氧化钡溶液与硫酸钠溶液,用少量的双氧水和二氧化锰分解),得出参加化学反应的各物质的质量总和
查看习题详情和答案>>
(1)分类法:利用下列4组物质请按要求填写下表横线上(填写物质的化学式或分类标准)(分类标准包括:酸、碱、盐、金属氧化物、非金属氧化物、金属单质、非金属单质)
A.ZnO、MgO、CO2、Na2O B.Cu、N2、C、Cl2
C.KNO3、NaHCO3、KClO3、Fe(OH)3 D.H2SO4、H2O、HCl、HNO3
| A | B | C | D | |
| 分类标准 | 金属氧化物 | 非金属单质 非金属单质 |
盐 | 酸 酸 |
| 不属于该类别的物质 | CO2 CO2 |
Cu | Fe(OH)3 Fe(OH)3 |
H2O |
A.通过对CO2+H2O→H2CO3 和 6CO2+6H2O
| 光照、叶绿素 |
生成的产物不同
生成的产物不同
.B.如图1所示:小海同学将盛有干燥白磷的甲试管和干燥红磷的乙试管插入盛有80℃的烧杯里(甲、乙试管均套有气球密封).过一会后,发现甲试管中的白磷燃烧,乙试管中的红磷没有燃烧.请根据小海同学的实验现象,对比得出可燃物燃烧所需的条件之一:
温度须达到可燃物的着火点
温度须达到可燃物的着火点
.
(3)归纳演绎法:
某同学通过对大量化学反应前后各物质的质量总和的测定分析(如图2中的氢氧化钡溶液与硫酸钠溶液,用少量的双氧水和二氧化锰分解),得出参加化学反应的各物质的质量总和
等于
等于
(填“大于”、“小于”或“等于”)反应后生成的各种物质的质量总和.根据该同学得出的结论可推出:高温煅烧含有杂质的石灰石125g(杂质不发生反应),充分反应后剩余固体质量为81g,则反应过程中生成二氧化碳的质量为44
44
g.请根据化学反应方程式列式计算①该石灰石中含碳酸钙的物质的量是多少?②该石灰石中含碳酸钙的质量分数是多少?