题目内容
学习热情和学习方法是成才的必备条件,灵活掌握不同的学习方法可以取得事半功倍的效果.请用以下方法解决下列问题:
(1)分类法:利用下列4组物质请按要求填写下表横线上(填写物质的化学式或分类标准)(分类标准包括:酸、碱、盐、金属氧化物、非金属氧化物、金属单质、非金属单质)
A.ZnO、MgO、CO2、Na2O B.Cu、N2、C、Cl2
C.KNO3、NaHCO3、KClO3、Fe(OH)3 D.H2SO4、H2O、HCl、HNO3
(2)对比法:
A.通过对CO2+H2O→H2CO3 和 6CO2+6H2O
C6H12O6+6O2两个化学反应的对比,你能得出的结论是:相同的反应物在不同的条件下
B.如图1所示:小海同学将盛有干燥白磷的甲试管和干燥红磷的乙试管插入盛有80℃的烧杯里(甲、乙试管均套有气球密封).过一会后,发现甲试管中的白磷燃烧,乙试管中的红磷没有燃烧.请根据小海同学的实验现象,对比得出可燃物燃烧所需的条件之一:

(3)归纳演绎法:
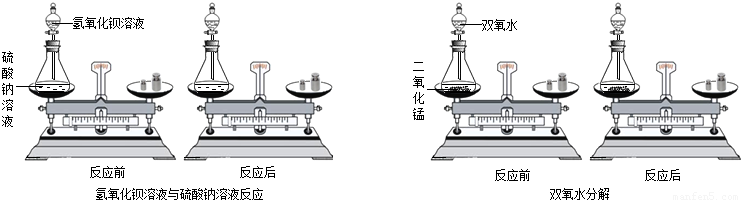
某同学通过对大量化学反应前后各物质的质量总和的测定分析(如图2中的氢氧化钡溶液与硫酸钠溶液,用少量的双氧水和二氧化锰分解),得出参加化学反应的各物质的质量总和
(1)分类法:利用下列4组物质请按要求填写下表横线上(填写物质的化学式或分类标准)(分类标准包括:酸、碱、盐、金属氧化物、非金属氧化物、金属单质、非金属单质)
A.ZnO、MgO、CO2、Na2O B.Cu、N2、C、Cl2
C.KNO3、NaHCO3、KClO3、Fe(OH)3 D.H2SO4、H2O、HCl、HNO3
| A | B | C | D | |
| 分类标准 | 金属氧化物 | 非金属单质 非金属单质 |
盐 | 酸 酸 |
| 不属于该类别的物质 | CO2 CO2 |
Cu | Fe(OH)3 Fe(OH)3 |
H2O |
A.通过对CO2+H2O→H2CO3 和 6CO2+6H2O
| 光照、叶绿素 |
生成的产物不同
生成的产物不同
.B.如图1所示:小海同学将盛有干燥白磷的甲试管和干燥红磷的乙试管插入盛有80℃的烧杯里(甲、乙试管均套有气球密封).过一会后,发现甲试管中的白磷燃烧,乙试管中的红磷没有燃烧.请根据小海同学的实验现象,对比得出可燃物燃烧所需的条件之一:
温度须达到可燃物的着火点
温度须达到可燃物的着火点
.
(3)归纳演绎法:
某同学通过对大量化学反应前后各物质的质量总和的测定分析(如图2中的氢氧化钡溶液与硫酸钠溶液,用少量的双氧水和二氧化锰分解),得出参加化学反应的各物质的质量总和
等于
等于
(填“大于”、“小于”或“等于”)反应后生成的各种物质的质量总和.根据该同学得出的结论可推出:高温煅烧含有杂质的石灰石125g(杂质不发生反应),充分反应后剩余固体质量为81g,则反应过程中生成二氧化碳的质量为44
44
g.请根据化学反应方程式列式计算①该石灰石中含碳酸钙的物质的量是多少?②该石灰石中含碳酸钙的质量分数是多少?分析:(1)根据金属氧化物、金属单质、酸碱盐的分类进行解答;
(2)A、对比这两个化学反应方程式的反应物、反应条件以及生成物的异同进行分析、填空;
B、根据物质燃烧的条件、对比两个试管中的物质所处环境的异同点进行分析;
(3)观察化学反应前、后天平的天平仍平衡,据此可知化学反应前、后物质的质量不变;根据质量守恒定律和化学方程式进行计算即可.
(2)A、对比这两个化学反应方程式的反应物、反应条件以及生成物的异同进行分析、填空;
B、根据物质燃烧的条件、对比两个试管中的物质所处环境的异同点进行分析;
(3)观察化学反应前、后天平的天平仍平衡,据此可知化学反应前、后物质的质量不变;根据质量守恒定律和化学方程式进行计算即可.
解答:解:(1)A、ZnO、MgO、Na2O这三种物质都是由金属元素和氧元素结合形成的化合物,属于金属氧化物,而CO2是由非金属元素和氧元素结合形成的化合物,属于非金属氧化物;
B、N2、C、Cl2这三种物质都是由非金属元素组成的单质,只有Cu是由金属元素组成的单质;
C、KNO3、NaHCO3、KClO3这三种物质都属于盐类,只有Fe(OH)3是碱;
D、H2SO4、HCl、HNO3这三种物质都属于酸,只有H2O是中性的;
故答案为:
(2)A、通过对两个化学反应的对比,发现它们的反应物相同,但是反应条件不同、生成物不同;
故答案为:生成的产物不同;
B、根据物质燃烧的条件可知,甲、乙试管所受温度相同,同样与氧气接触,甲试管中的白磷能燃烧,乙试管中的红磷不能燃烧,说明乙试管中的红磷没有达到着火点.
故答案为:温度须达到可燃物的着火点;
(3)从图可以看出,天平在化学反应前后都是保持平衡状态,所以参加化学反应的各物质的质量总和等于反应后生成的各种物质的质量总和;
根据质量守恒定律可知,反应生成二氧化碳的质量为125g-81g=44g;
①设该石灰石中含碳酸钙的物质的量是x,
CaCO3
CaO+CO2↑
100 44
x 44g
=
,解得x=100g;
②该石灰石中含碳酸钙的质量分数是
×100%=80%.
故答案为:等于;44;①100g;②80%.
B、N2、C、Cl2这三种物质都是由非金属元素组成的单质,只有Cu是由金属元素组成的单质;
C、KNO3、NaHCO3、KClO3这三种物质都属于盐类,只有Fe(OH)3是碱;
D、H2SO4、HCl、HNO3这三种物质都属于酸,只有H2O是中性的;
故答案为:
| A | B | C | D | |
| 非金属单质 | 酸 | |||
| CO2 | Fe(OH)3 |
故答案为:生成的产物不同;
B、根据物质燃烧的条件可知,甲、乙试管所受温度相同,同样与氧气接触,甲试管中的白磷能燃烧,乙试管中的红磷不能燃烧,说明乙试管中的红磷没有达到着火点.
故答案为:温度须达到可燃物的着火点;
(3)从图可以看出,天平在化学反应前后都是保持平衡状态,所以参加化学反应的各物质的质量总和等于反应后生成的各种物质的质量总和;
根据质量守恒定律可知,反应生成二氧化碳的质量为125g-81g=44g;
①设该石灰石中含碳酸钙的物质的量是x,
CaCO3
| ||
100 44
x 44g
| 100 |
| 44 |
| x |
| 44g |
②该石灰石中含碳酸钙的质量分数是
| 100g |
| 125g |
故答案为:等于;44;①100g;②80%.
点评:解答(3)时,要熟知化学反应的实质是原子的重新组合,推出原子的种类、数目、质量都没有改变,所以化学反应前后各物质的质量总和必然相等.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
学习热情和学习方法是成才的必备条件,灵活掌握不同的学习方法可以取得事半功倍的效果.请用以下方法解决下列问题:
(1)分类法:利用下列4组物质
A.ZnO、MgO、CO2、Na2O B.Cu、N2、O2、Cl2
C.KNO3、NaHCO3、KClO3、Fe(OH)3 D.H2SO4、H2O、HCl、HNO3
请按要求填写下表空白(填写物质的化学式或分类标准)
| \ | A | B | C | D |
| 分类标准 | 金属氧化物 | ________ | 盐 | ________ |
| 不属于该类别的物质 | ________ | Cu | ________ | H2O |
A.通过对CO2+H2O═H2CO3;6CO2+6H2O
 C6H12O6+6O2两个化学反应的对比,你能得出的结论是________.
C6H12O6+6O2两个化学反应的对比,你能得出的结论是________.B.如图所示:小海同学将盛有干燥白磷的甲试管和干燥红磷的乙试管插入盛有80℃的烧杯里(甲、乙试管均套有气球密封).过一会后,发现甲试管中的白磷燃烧,乙试管中的红磷没有燃烧.请根据小海同学的实验现象,对比得出可燃物燃烧所需的条件之一:________.

(3)归纳演绎法:
小海同学通过对大量化学反应如氢氧化钡溶液与硫酸钠溶液,双氧水分解(如下图)反应前后各物质的质量总和的测定,得出参加化学反应的各物质的质量总和________(填“大于”、“小于”或“等于”)反应后生成的各种物质的质量总和.

根据小海得出的结论,可推出7.9g高锰酸钾加热一会后,剩余固体质量为7.5g,则反应生成氧气的质量为________g.
学习热情和学习方法是成才的必备条件,灵活掌握不同的学习方法可以取得事半功倍的效果.请用以下方法解决下列问题:
(1)分类法:利用下列4组物质
A.ZnO、MgO、CO2、Na2O B.Cu、N2、O2、Cl2
C.KNO3、NaHCO3、KClO3、Fe(OH)3 D.H2SO4、H2O、HCl、HNO3
请按要求填写下表空白(填写物质的化学式或分类标准)
(2)对比法:
A.通过对CO2+H2O═H2CO3;6CO2+6H2O C6H12O6+6O2两个化学反应的对比,你能得出的结论是 .
C6H12O6+6O2两个化学反应的对比,你能得出的结论是 .
B.如图所示:小海同学将盛有干燥白磷的甲试管和干燥红磷的乙试管插入盛有80℃的烧杯里(甲、乙试管均套有气球密封).过一会后,发现甲试管中的白磷燃烧,乙试管中的红磷没有燃烧.请根据小海同学的实验现象,对比得出可燃物燃烧所需的条件之一: .

(3)归纳演绎法:
小海同学通过对大量化学反应如氢氧化钡溶液与硫酸钠溶液,双氧水分解(如下图)反应前后各物质的质量总和的测定,得出参加化学反应的各物质的质量总和 (填“大于”、“小于”或“等于”)反应后生成的各种物质的质量总和.
根据小海得出的结论,可推出7.9g高锰酸钾加热一会后,剩余固体质量为7.5g,则反应生成氧气的质量为 g.
(1)分类法:利用下列4组物质
A.ZnO、MgO、CO2、Na2O B.Cu、N2、O2、Cl2
C.KNO3、NaHCO3、KClO3、Fe(OH)3 D.H2SO4、H2O、HCl、HNO3
请按要求填写下表空白(填写物质的化学式或分类标准)
| \ | A | B | C | D |
| 分类标准 | 金属氧化物 | 盐 | ||
| 不属于该类别的物质 | Cu | H2O |
A.通过对CO2+H2O═H2CO3;6CO2+6H2O
 C6H12O6+6O2两个化学反应的对比,你能得出的结论是 .
C6H12O6+6O2两个化学反应的对比,你能得出的结论是 .B.如图所示:小海同学将盛有干燥白磷的甲试管和干燥红磷的乙试管插入盛有80℃的烧杯里(甲、乙试管均套有气球密封).过一会后,发现甲试管中的白磷燃烧,乙试管中的红磷没有燃烧.请根据小海同学的实验现象,对比得出可燃物燃烧所需的条件之一: .

(3)归纳演绎法:
小海同学通过对大量化学反应如氢氧化钡溶液与硫酸钠溶液,双氧水分解(如下图)反应前后各物质的质量总和的测定,得出参加化学反应的各物质的质量总和 (填“大于”、“小于”或“等于”)反应后生成的各种物质的质量总和.

根据小海得出的结论,可推出7.9g高锰酸钾加热一会后,剩余固体质量为7.5g,则反应生成氧气的质量为 g.


 学习热情和学习方法是成才的必备条件,灵活掌握不同的学习方法可以取得事半功倍的效果.如图所示:小海同学将盛有干燥白磷的甲试管和干燥红磷的乙试管插入盛有80℃的烧杯里(甲、乙试管均套有气球密封).过一会后,发现甲试管中的
学习热情和学习方法是成才的必备条件,灵活掌握不同的学习方法可以取得事半功倍的效果.如图所示:小海同学将盛有干燥白磷的甲试管和干燥红磷的乙试管插入盛有80℃的烧杯里(甲、乙试管均套有气球密封).过一会后,发现甲试管中的