摘要:C 解析: 单位质量的某种物质温度升高1℃吸收的热量叫做这种物质的比热容.简称比热. 比热是通过比较单位质量的某种物质温升1℃时吸收的热量.来表示各种物质的不同性质. 水的比热最大.这就意味着.在同样受热或冷却的情况下.水的温度变化要小些.
网址:http://m.1010jiajiao.com/timu3_id_137627[举报]
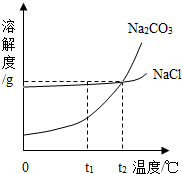 我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:(1)①t1℃时,NaCl的溶解度
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而
③“夏天晒盐”是利用
A.利用风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
(2)根据下表分析:
| 温度 物质 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |
②下列几种说法中,正确的是
A.碳酸钠晶体的溶解度受温度影响较大
B.将含水各1OOg的氯化钠与碳酸钠的饱和溶液,从30℃降至O℃,析出晶体的质量相等 C.t2对应的温度在2O℃-30℃之间
D.欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式. 查看习题详情和答案>>
 我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
(1)①t1℃时,NaCl的溶解度______ Na2CO3的溶解度.(用“>”“<”或“=”表达)
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而______(填“增大”“减小”或“不变”).“捞碱”后剩余的溶液一定是Na2CO3的______(填“饱和”或“不饱和”)溶液.
③“夏天晒盐”是利用______(填序号)的方法,使NaCl晶体析出.
A.利用风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
(2)根据下表分析:
| 温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |
②下列几种说法中,正确的是______.
A.碳酸钠晶体的溶解度受温度影响较大
B.将含水各1OOg的氯化钠与碳酸钠的饱和溶液,从30℃降至O℃,析出晶体的质量相等 C.t2对应的温度在2O℃-30℃之间
D.欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式. 查看习题详情和答案>>
我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
(1)①t1℃时,NaCl的溶解度 Na2CO3的溶解度.(用“>”“<”或“=”表达)
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而 (填“增大”“减小”或“不变”).“捞碱”后剩余的溶液一定是Na2CO3的 (填“饱和”或“不饱和”)溶液.
③“夏天晒盐”是利用 (填序号)的方法,使NaCl晶体析出.
A.利用风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
(2)根据下表分析:
①20℃时,向50克水中加入20克氯化钠固体,充分搅拌,所得的溶液溶质质量分数为 ,(最后结果保留一位小数)若使其中的氯化钠完全溶解,所采取的最有效的措施是 .
②下列几种说法中,正确的是 .
A.碳酸钠晶体的溶解度受温度影响较大
B.将含水各1OOg的氯化钠与碳酸钠的饱和溶液,从30℃降至O℃,析出晶体的质量相等 C.t2对应的温度在2O℃-30℃之间
D.欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式.
 查看习题详情和答案>>
查看习题详情和答案>>
(1)①t1℃时,NaCl的溶解度 Na2CO3的溶解度.(用“>”“<”或“=”表达)
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而 (填“增大”“减小”或“不变”).“捞碱”后剩余的溶液一定是Na2CO3的 (填“饱和”或“不饱和”)溶液.
③“夏天晒盐”是利用 (填序号)的方法,使NaCl晶体析出.
A.利用风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
(2)根据下表分析:
| 温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |
②下列几种说法中,正确的是 .
A.碳酸钠晶体的溶解度受温度影响较大
B.将含水各1OOg的氯化钠与碳酸钠的饱和溶液,从30℃降至O℃,析出晶体的质量相等 C.t2对应的温度在2O℃-30℃之间
D.欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式.
 查看习题详情和答案>>
查看习题详情和答案>>
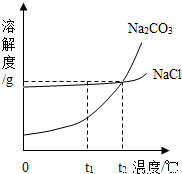
(2013?门头沟区二模)我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
(1)①t1℃时,NaCl的溶解度 Na2CO3的溶解度.(用“>”“<”或“=”表达)
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而(填“增大”“减小”或“不变”).“捞碱”后剩余的溶液一定是Na2CO3的(填“饱和”或“不饱和”)溶液.
③“夏天晒盐”是利用(填序号)的方法,使NaCl晶体析出.
A.利用风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
(2)根据下表分析:
①20℃时,向50克水中加入20克氯化钠固体,充分搅拌,所得的溶液溶质质量分数为,(最后结果保留一位小数)若使其中的氯化钠完全溶解,所采取的最有效的措施是.
②下列几种说法中,正确的是.
A.碳酸钠晶体的溶解度受温度影响较大
B.将含水各1OOg的氯化钠与碳酸钠的饱和溶液,从30℃降至O℃,析出晶体的质量相等 C.t2对应的温度在2O℃-30℃之间
D.欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式.
 查看习题详情和答案>>
查看习题详情和答案>>
(1)①t1℃时,NaCl的溶解度 Na2CO3的溶解度.(用“>”“<”或“=”表达)
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而(填“增大”“减小”或“不变”).“捞碱”后剩余的溶液一定是Na2CO3的(填“饱和”或“不饱和”)溶液.
③“夏天晒盐”是利用(填序号)的方法,使NaCl晶体析出.
A.利用风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
(2)根据下表分析:
| 温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |
②下列几种说法中,正确的是.
A.碳酸钠晶体的溶解度受温度影响较大
B.将含水各1OOg的氯化钠与碳酸钠的饱和溶液,从30℃降至O℃,析出晶体的质量相等 C.t2对应的温度在2O℃-30℃之间
D.欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式.
 查看习题详情和答案>>
查看习题详情和答案>>
(12分)二十一世纪是海洋开发与利用的世纪,我市实施黄蓝两大国家战略形成新的发展格局,海洋化学资源的综合利用将是重点发展领域之一。
(1)海水晒盐:将海水引入蒸发池,经日晒蒸发到一定程度时,导入结晶池,继续日晒,海水就会成为食盐的饱和溶液,再晒就会逐渐析出粗盐,剩余的液体称为母液(也称卤水)。
1L海水在逐渐浓缩过程中不断析出的盐的种类和质量(单位:g)关系如下表所示:
I、海水晒盐是 (选填“物理”或“化学”)变化,包含蒸发、 等过程。
II、若得到纯度较高的粗盐和含浓度较高的卤水,卤水的密度应控制在什么范围 ,原因是 。
(2)海水制镁:海水晒盐后,以其母液(卤水)和贝壳(主要成分是CaCO3)为原料制镁,其工艺流程如下图所示:

I、步骤①所加的碱应该是 (选填“氢氧化钠”或“石灰乳”),步骤②反应的化学方程式是 ;若要验证镁、铁、铜的活动性顺序,选择铁丝后,还要选择 、 两种溶液。
II、Mg(OH)2加热分解生成MgO和H2O,MgO是高熔点的化合物,某些阻燃剂(阻碍燃烧的物质)的有效成分是Mg(OH)2。你认为Mg(OH)2能够阻燃的原因可能是 (选填序号)
A.Mg(OH)2分解需要吸收大量的热,降低了可燃物的着火点
B.生成的氧化镁覆盖在可燃物表面,隔绝了空气
C.生成的水蒸气降低了可燃物周围氧气浓度
D.反应因吸热降低了环境温度,使可燃物不易达到着火点
(1)海水晒盐:将海水引入蒸发池,经日晒蒸发到一定程度时,导入结晶池,继续日晒,海水就会成为食盐的饱和溶液,再晒就会逐渐析出粗盐,剩余的液体称为母液(也称卤水)。
1L海水在逐渐浓缩过程中不断析出的盐的种类和质量(单位:g)关系如下表所示:
| 海水密度(g/mL) | CaSO4 | NaCl | MgCl2 | MgSO4 |
| 1.20 | 0.91 | | | |
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 |
| 1.31 | | 1.40 | 0.54 | 0.03 |
II、若得到纯度较高的粗盐和含浓度较高的卤水,卤水的密度应控制在什么范围 ,原因是 。
(2)海水制镁:海水晒盐后,以其母液(卤水)和贝壳(主要成分是CaCO3)为原料制镁,其工艺流程如下图所示:

I、步骤①所加的碱应该是 (选填“氢氧化钠”或“石灰乳”),步骤②反应的化学方程式是 ;若要验证镁、铁、铜的活动性顺序,选择铁丝后,还要选择 、 两种溶液。
II、Mg(OH)2加热分解生成MgO和H2O,MgO是高熔点的化合物,某些阻燃剂(阻碍燃烧的物质)的有效成分是Mg(OH)2。你认为Mg(OH)2能够阻燃的原因可能是 (选填序号)
A.Mg(OH)2分解需要吸收大量的热,降低了可燃物的着火点
B.生成的氧化镁覆盖在可燃物表面,隔绝了空气
C.生成的水蒸气降低了可燃物周围氧气浓度
D.反应因吸热降低了环境温度,使可燃物不易达到着火点