摘要:某地赤铁矿中氧化铁[Fe2O3]的质量分数是50%.杂质不含铁元素.则赤铁矿中铁元素质量分数是多少?
网址:http://m.1010jiajiao.com/timu3_id_136861[举报]
对生活中常见金属的有关问题探究:
人类从石器时代进入青铜器时代,继而进入铁器时代;前两个世纪中钢铁产量是衡量国家工业和经济发展的标志.可见金属材料长期以来一直被广泛地应用着.对金属材料的探究要用到许多化学知识.
(1)“金属之最”:完成(1)~(2)的空格,并以此为例,再另外写出两个“金属之最”.
①目前世界上年产量最高的金属是
②地壳中含量最多的金属是
③
(2)“变废为宝,回收利用”:某厂的废液中含有H2SO4和CuSO4,为了防止废酸和CuSO4污染环境,厂家设计用含铁的废弃物回收金属铜,同时生产重要的化工原料硫酸亚铁晶体,设计原理如图所示:
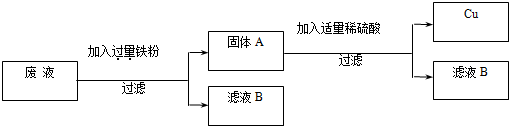
请你根据上述设计方案写出有关化学方程式: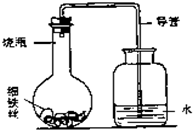
(3)“锈蚀条件的探究”:某学生在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
①导管中水面为什么会上升?
②上述实验中,铁生锈的速率由大到小的排列顺序为(填小烧瓶号):
③影响铁生锈的因素有:
(4)“金属的防护”:对如何防止你的自行车的钢圈生锈提出两种方案.
(5)“金属的冶炼”:某钢铁厂日产含4%杂质的生铁2240吨.问:需要含Fe2O3质量分数为80%的赤铁矿石多少吨?
查看习题详情和答案>>
人类从石器时代进入青铜器时代,继而进入铁器时代;前两个世纪中钢铁产量是衡量国家工业和经济发展的标志.可见金属材料长期以来一直被广泛地应用着.对金属材料的探究要用到许多化学知识.
(1)“金属之最”:完成(1)~(2)的空格,并以此为例,再另外写出两个“金属之最”.
①目前世界上年产量最高的金属是
铁
铁
;②地壳中含量最多的金属是
铝
铝
;③
熔点最低的金属是汞
熔点最低的金属是汞
;④熔点最高的金属是钨
熔点最高的金属是钨
.(2)“变废为宝,回收利用”:某厂的废液中含有H2SO4和CuSO4,为了防止废酸和CuSO4污染环境,厂家设计用含铁的废弃物回收金属铜,同时生产重要的化工原料硫酸亚铁晶体,设计原理如图所示:

请你根据上述设计方案写出有关化学方程式:
Fe+H2SO4 ═FeSO4+H2↑
Fe+H2SO4 ═FeSO4+H2↑
;Fe+CuSO4═Cu+FeSO4
Fe+CuSO4═Cu+FeSO4
.
(3)“锈蚀条件的探究”:某学生在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
| 时间/小时 | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| A瓶(盛干燥铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| B瓶(盛沾了食盐水的铁丝) | 0 | 0.4 | 1.2 | 3.4 | 5.6 | 7.6 | 9.8 |
| C瓶(盛沾了清水的铁丝) | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
| D瓶(盛完全浸没在食盐水中的铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
铁生锈时消耗氧气,使瓶内压强降低
铁生锈时消耗氧气,使瓶内压强降低
.②上述实验中,铁生锈的速率由大到小的排列顺序为(填小烧瓶号):
B>C>A=D
B>C>A=D
.③影响铁生锈的因素有:
水和氧气,有盐溶液速度最快.
水和氧气,有盐溶液速度最快.
.(4)“金属的防护”:对如何防止你的自行车的钢圈生锈提出两种方案.
镀一层金属或涂油
镀一层金属或涂油
.(5)“金属的冶炼”:某钢铁厂日产含4%杂质的生铁2240吨.问:需要含Fe2O3质量分数为80%的赤铁矿石多少吨?
人类的生产和生活都离不开金属.
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是______.金属以矿物形式存在,下列矿石的主要成分属于氧化物的是______(填化学式).
赤铁矿 孔雀石 铝土矿
(主要成分Fe2O3)〔主要成分Cu2(OH)2CO3〕(主要成分Al2O3)
(2)金属的回收和利用是保护金属资源的一种有效途径.
①废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为______.
②向含有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,则下列结论正确的是______
A.固体中一定有Fe、Ag,可能有 Cu、Zn
B. 固体中一定有Fe、Zn,可能有 Cu、Ag
C.滤液中一定含Fe2+、Zn2+,不含Cu2+、Ag+
D.滤液中一定含Zn2+、Fe2+,可能含Cu2+
(3)某次实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放会造成水污染.于是几位同学利用课余时间处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如下:
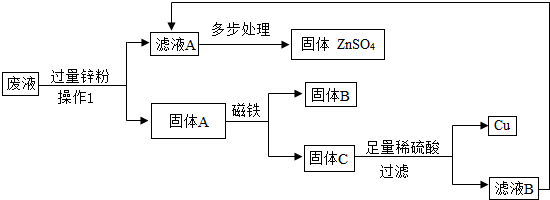
请回答:
①操作1的名称是______;固体A的成分为______.
②若要检验向固体C中加入的稀硫酸是否足量的方法是______.
③若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量废液的质量、蒸发得到固体硫酸锌的质量和______..
查看习题详情和答案>>
(2013?北京一模)人类的生产和生活都离不开金属.
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是
赤铁矿 孔雀石 铝土矿
(主要成分Fe2O3)〔主要成分Cu2(OH)2CO3〕(主要成分Al2O3)
(2)金属的回收和利用是保护金属资源的一种有效途径.
①废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为
②向含有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,则下列结论正确的是
A.固体中一定有Fe、Ag,可能有 Cu、Zn
B. 固体中一定有Fe、Zn,可能有 Cu、Ag
C.滤液中一定含Fe2+、Zn2+,不含Cu2+、Ag+
D.滤液中一定含Zn2+、Fe2+,可能含Cu2+
(3)某次实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放会造成水污染.于是几位同学利用课余时间处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如下:

请回答:
①操作1的名称是
②若要检验向固体C中加入的稀硫酸是否足量的方法是
③若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量废液的质量、蒸发得到固体硫酸锌的质量和
查看习题详情和答案>>
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是
Al
Al
.金属以矿物形式存在,下列矿石的主要成分属于氧化物的是Fe2O3、Al2O3
Fe2O3、Al2O3
(填化学式).赤铁矿 孔雀石 铝土矿
(主要成分Fe2O3)〔主要成分Cu2(OH)2CO3〕(主要成分Al2O3)
(2)金属的回收和利用是保护金属资源的一种有效途径.
①废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
②向含有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,则下列结论正确的是
C
C
A.固体中一定有Fe、Ag,可能有 Cu、Zn
B. 固体中一定有Fe、Zn,可能有 Cu、Ag
C.滤液中一定含Fe2+、Zn2+,不含Cu2+、Ag+
D.滤液中一定含Zn2+、Fe2+,可能含Cu2+
(3)某次实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放会造成水污染.于是几位同学利用课余时间处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如下:

请回答:
①操作1的名称是
过滤
过滤
;固体A的成分为Zn、Fe、Cu
Zn、Fe、Cu
.②若要检验向固体C中加入的稀硫酸是否足量的方法是
取少量铜,加适量稀硫酸,若无气泡产生,证明硫酸足量
取少量铜,加适量稀硫酸,若无气泡产生,证明硫酸足量
.③若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量废液的质量、蒸发得到固体硫酸锌的质量和
操作1中加入锌粉的质量
操作1中加入锌粉的质量
..(7分)保护环境,提倡“低碳生活”,是我们都应关注的社会问题。
⑴目前,一些汽车已改用压缩天然气(CNG)做燃料,以减少对空气污染。
①天然气(主要成分为CH4)完全燃烧的化学方程式为 ;
②从下表数据分析,与煤相比,用天然气做燃料的优点是 。
| | 1g 物质完全燃烧产生CO2的质量 | 1g 物质完全燃烧放出的热量 |
| CH4 | 2.75g | 56 KJ |
| C | 3.67g | 32 KJ |
⑶为限制二氧化碳等温室气体的排放量,科学家采取“组合转化”技术,将二氧化碳和氢气在催化剂和加热条件下转化为一种重要的化工原料乙烯(C2H4)和水,该反应化学方程式为 。
⑷某地区赤铁矿(主要成分是Fe2O3)和黄铁矿(主要成分是FeS2)储量丰富。若从保护环境的角度考虑,当地炼铁厂应选用的铁矿石是 。为了提高铁矿石的利用率,常将块状铁矿石 ,该高炉炼铁的化学方程式为 。 查看习题详情和答案>>
(7分)保护环境,提倡“低碳生活”, 是我们都应关注的社会问题。
⑴ 目前,一些汽车已改用压缩天然气(CNG)做燃料,以减少对空气污染。
① 天然气(主要成分为CH4)完全燃烧的化学方程式为 ;
② 从下表数据分析,与煤相比,用天然气做燃料的优点是 。
|
|
1g 物质完全燃烧产生CO2的质量 |
1g 物质完全燃烧放出的热量 |
|
CH4 |
2.75g |
56 KJ |
|
C |
3.67g |
32 KJ |
⑵ 生活中少买一件不必要的衣服可以节约2.5 kg标准煤(已知标准煤的平均含碳量为72%),则相应减排二氧化碳 kg。
⑶ 为限制二氧化碳等温室气体的排放量,科学家采取“组合转化”技术,将二氧化碳和氢气在催化剂和加热条件下转化为一种重要的化工原料乙烯(C2H4)和水,该反应化学方程式为 。
⑷ 某地区赤铁矿(主要成分是Fe2O3)和黄铁矿(主要成分是FeS2)储量丰富。若从保护环境的角度考虑,当地炼铁厂应选用的铁矿石是 。为了提高铁矿石的利用率,常将块状铁矿石 ,该高炉炼铁的化学方程式为 。
查看习题详情和答案>>