题目内容
人类的生产和生活都离不开金属.
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是______.金属以矿物形式存在,下列矿石的主要成分属于氧化物的是______(填化学式).
赤铁矿 孔雀石 铝土矿
(主要成分Fe2O3)〔主要成分Cu2(OH)2CO3〕(主要成分Al2O3)
(2)金属的回收和利用是保护金属资源的一种有效途径.
①废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为______.
②向含有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,则下列结论正确的是______
A.固体中一定有Fe、Ag,可能有 Cu、Zn
B. 固体中一定有Fe、Zn,可能有 Cu、Ag
C.滤液中一定含Fe2+、Zn2+,不含Cu2+、Ag+
D.滤液中一定含Zn2+、Fe2+,可能含Cu2+
(3)某次实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放会造成水污染.于是几位同学利用课余时间处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如下:
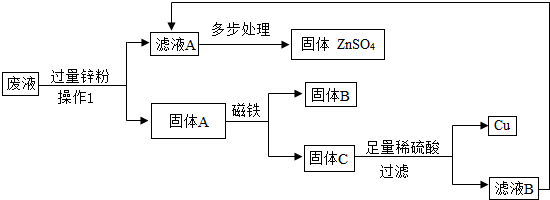
请回答:
①操作1的名称是______;固体A的成分为______.
②若要检验向固体C中加入的稀硫酸是否足量的方法是______.
③若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量废液的质量、蒸发得到固体硫酸锌的质量和______..
解:(1)地壳中含量最多的金属元素是铝元素,氧化物是指含有两种元素其中一种是氧元素的纯净物,所以下列矿石的主要成分属于氧化物的是Fe2O3和Al2O3;
(2)①一氧化碳还原氧化铁生成铁和二氧化碳,化学方程式为Fe2O3+3CO 2Fe+3CO2;
2Fe+3CO2;
②向含有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,铁粉先和硝酸银溶液反应生成银和硝酸亚铁,反应完后再和硝酸铜溶液反应生成铜和硝酸亚铁,铁粉不和硝酸锌溶液反应,所以使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,说明一定金属铁有剩余,故滤液中一定含Fe2+、Zn2+,不含Cu2+、Ag+;
(3)锌先和硫酸铜溶液反应生成铜和硫酸锌,反应完后再和硫酸亚铁溶液反应生成铁和硫酸锌.
①过滤用于分离不溶性固体,所以操作1的名称是过滤;加入过量的锌粉,所以固体A的成分为 Zn、Fe、Cu;
②若要检验向固体C中加入的稀硫酸是否足量的方法是取少量铜,加适量稀硫酸,若无气泡产生,证明硫酸足量;
③若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量废液的质量、蒸发得到固体硫酸锌的质量和操作1中加入锌粉的质量.
故答案为:(1)Al;Fe2O3、Al2O3;
(2)Fe2O3+3CO 2Fe+3CO2;C;
2Fe+3CO2;C;
(3)①过滤;Zn、Fe、Cu;
②取少量铜,加适量稀硫酸,若无气泡产生,证明硫酸足量;
③操作1中加入锌粉的质量.
分析:(1)根据地壳中含量最多的金属元素是铝元素以及氧化物是指含有两种元素其中一种是氧元素的纯净物进行解答;
(2)根据一氧化碳还原氧化铁生成铁和二氧化碳以及向含有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,铁粉先和硝酸银溶液反应生成银和硝酸亚铁,反应完后再和硝酸铜溶液反应生成铜和硝酸亚铁,铁粉不和硝酸锌溶液反应进行解答;
(3)根据锌先和硫酸铜溶液反应生成铜和硫酸锌,反应完后再和硫酸亚铁溶液反应生成铁和硫酸锌进行解答.
点评:仔细审题,有题意可知一些信息,根据信息推导做题;利用金属活动性顺序,回收工业重要原料硫酸锌和有关金属.
(2)①一氧化碳还原氧化铁生成铁和二氧化碳,化学方程式为Fe2O3+3CO
 2Fe+3CO2;
2Fe+3CO2;②向含有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,铁粉先和硝酸银溶液反应生成银和硝酸亚铁,反应完后再和硝酸铜溶液反应生成铜和硝酸亚铁,铁粉不和硝酸锌溶液反应,所以使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,说明一定金属铁有剩余,故滤液中一定含Fe2+、Zn2+,不含Cu2+、Ag+;
(3)锌先和硫酸铜溶液反应生成铜和硫酸锌,反应完后再和硫酸亚铁溶液反应生成铁和硫酸锌.
①过滤用于分离不溶性固体,所以操作1的名称是过滤;加入过量的锌粉,所以固体A的成分为 Zn、Fe、Cu;
②若要检验向固体C中加入的稀硫酸是否足量的方法是取少量铜,加适量稀硫酸,若无气泡产生,证明硫酸足量;
③若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量废液的质量、蒸发得到固体硫酸锌的质量和操作1中加入锌粉的质量.
故答案为:(1)Al;Fe2O3、Al2O3;
(2)Fe2O3+3CO
 2Fe+3CO2;C;
2Fe+3CO2;C;(3)①过滤;Zn、Fe、Cu;
②取少量铜,加适量稀硫酸,若无气泡产生,证明硫酸足量;
③操作1中加入锌粉的质量.
分析:(1)根据地壳中含量最多的金属元素是铝元素以及氧化物是指含有两种元素其中一种是氧元素的纯净物进行解答;
(2)根据一氧化碳还原氧化铁生成铁和二氧化碳以及向含有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一定量的铁粉,铁粉先和硝酸银溶液反应生成银和硝酸亚铁,反应完后再和硝酸铜溶液反应生成铜和硝酸亚铁,铁粉不和硝酸锌溶液反应进行解答;
(3)根据锌先和硫酸铜溶液反应生成铜和硫酸锌,反应完后再和硫酸亚铁溶液反应生成铁和硫酸锌进行解答.
点评:仔细审题,有题意可知一些信息,根据信息推导做题;利用金属活动性顺序,回收工业重要原料硫酸锌和有关金属.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
