网址:http://m.1010jiajiao.com/timu3_id_136860[举报]
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气.
进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):
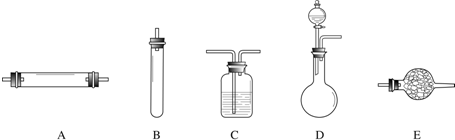
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置
(3)方法三:制氮气的化学方程式为:
| ||
| ||
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂.在制取氮气的3种方法中,联合使用方法一和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:
(5)1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大5‰左右.若上述实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气,产物中还含有相对分子量最小的氧化物.进行实验时可选择的实验仪器如图所示(省略夹持装置与加热装置):
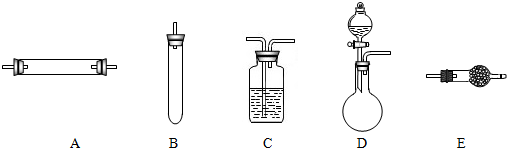
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置_
(3)方法三:制氮气的化学方程式为
| ||
| ||
(4)1892年,英国科学家瑞利(( Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大50‰.左右.若上述实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因:
【Ⅰ】他们用砂纸打磨掉表面灰黑色的物质,将其放入水中,未看到有明显的现象,改用酒精灯加热后,观察到表面有大量气泡,经验是氢气.他们又向溶液中滴加无色酚酞试液,发现酚酞变成红色,说明有
【Ⅱ】该小组成员开始研究镁带表面的灰黑色物质,小王大胆提出了三个假设:
假设1该物质是MgO;假设2该物质是Mg(OH)2;假设3镁可能会象铜一样生成碱式碳酸镁.
但其它同这立即否定了他的假设1和2,因为根据所学的知识MgO,Mg(OH)2都是
| 实验方案 | 实验现象 | 实验结论 |
| 证明有CO32- | ||
| 取样于试管,加热 | 证明有氢元素 |
(1)2Mg+CO2=2MgO+C; (2)C+2H2SO4(浓)=CO2↑+SO2↑+H2O;(3)SO2+Ca(OH)2=CaSO3↓(白)+H2O.
试分析A物质为
| 实验方案 | 实验现象 | 实验结论 |
| 取反应后试管内样品,先滴加过量的 稀硫酸 稀硫酸 |
固体部分溶解 | |
| 再 加热 加热 (填一具体的实验操作) |
黑色固体全部溶解 |
气体→
(现象依次为)
【V】该兴趣小组的同学进一步又查出胃药碱式碳酸镁有多种不同的组成,如Mg2(OH)2CO3、Mg4(OH)2(CO3)3、Mg5(OH)2(CO3)4等.小红同学为确定碱式碳酸镁的组成,设计如图所示的实验:
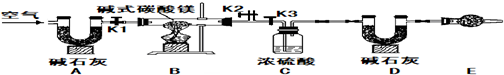
实验步骤(1)按图组装置后,首先进行的操作是
实验步骤(2)称取样品31g,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量为87.6g,装碱石灰的U型管D的质量为74.7g.
实验步骤(3)打开活塞
实验步骤(4)关闭活塞
实验步骤(5)打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,称得洗气瓶C的质量为89.4g,U型管D的质量为87.9g,则该碱式碳酸镁的化学式为
【Ⅵ】小明认为其化学式可用Mgx(OH)2(CO3)y表示,根据化合价规律,x和y的关系是
| ||
| ||
小明设计了两套方案(忽略装置中原来的气体)
方案I:只测定分解后生成的水,连接方案是A→C→B,则C中盛放的药品是
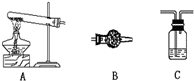
方案II:只测定分解生成的CO2的质量,连接方案是A→C→B→C,则B中的药品是
请你设计出更简单的实验方法
若取样品7.88克,方案I测得生成水0.36g,方案II测得生成CO2 3.52g,请你选择实验数据,通过计算得出碱式碳酸镁的化学式.
(14分)实验室获取氮气有很多种途径,常见的有3种方法。
方法一:将氨气(NH3)通过赤热的装有氧化铜的玻璃管,生成铜、氮气和水蒸气,除去水蒸气后测得氮气的密度为1.2508g/L。
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末,测得该气体的密度为1.2572g/L。 进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置)。
为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置 (选填装置编号)中加入 (填名称)以除去其它杂质气体。
方法三:将亚硝酸钠(NaNO2)和氯化铵的饱和溶液加热,氮元素全部转化为氮气。下图是实验室用这种方法制N2,并测定生成N2体积的装置(部分装置略去),请回答相关问题。
【查阅资料】
(1)NaNO2+NH4Cl NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
(此反应会放出大量的热);
(2)B部分中冰盐是冷凝作用
【实验探究】
① ;
②20℃时,取含溶质0.21g饱和NH4Cl溶液放入烧瓶,连接装置;
③调节水准管,使其与量气管中液面相平,记录量气管中水面读数为12.0mL;
④打开分液漏斗活塞,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯;
⑤烧瓶中不再产生气泡时,关闭活塞;
⑥待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为100.0mL;
⑦处理剩余药品,整理实验台。
【实验分析及数据处理】
(1)加入药品前必须进行的实验①是 ;
(2)步骤④中,移走酒精灯的目的是 ;
(3)计算生成氮气的质量和密度。 (4分,计算过程中以及最终数据均保留2位小数)
【解释与结论】
1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比其他方法得到的纯氮气密度总是偏大5‰左右。若实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因是 (已知:相同条件下,气体的相对分子质量越大,密度就越大)
【反思与评价】
(1)装置中A部分的分液漏斗与蒸馏瓶之间连接的导管所起的作用是
C
防止NaNO2饱和溶液蒸发 B.保证实验装置不漏气
C.使NaNO2饱和溶液顺利滴下 D.防止溶液冲入U形管
(2)科学家瑞利仅仅是从小数点第三位数的差别,发现了新物质。这启示我们在今后的学习 和生活中要学习科学家的 .
A.严谨求实的科学态度和敢于怀疑的批判精神
B.科学研究中遇到疑惑就趁早放弃,不要浪费时间
C.不能因为微小的差异而放过一次成功的机会
D.要相信权威,权威一定是正确的
方法一:将氨气(NH3)通过赤热的装有氧化铜的玻璃管,生成铜、氮气和水蒸气,除去水蒸气后测得氮气的密度为1.2508g/L。
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末,测得该气体的密度为1.2572g/L。 进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置)。
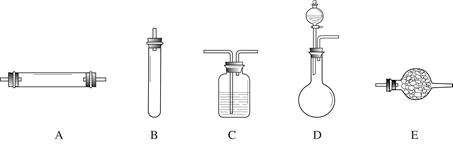
为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置 (选填装置编号)中加入 (填名称)以除去其它杂质气体。
方法三:将亚硝酸钠(NaNO2)和氯化铵的饱和溶液加热,氮元素全部转化为氮气。下图是实验室用这种方法制N2,并测定生成N2体积的装置(部分装置略去),请回答相关问题。
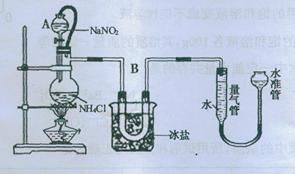
【查阅资料】
(1)NaNO2+NH4Cl
 NaCl+N2↑+2H2O
NaCl+N2↑+2H2O(此反应会放出大量的热);
(2)B部分中冰盐是冷凝作用
【实验探究】
① ;
②20℃时,取含溶质0.21g饱和NH4Cl溶液放入烧瓶,连接装置;
③调节水准管,使其与量气管中液面相平,记录量气管中水面读数为12.0mL;
④打开分液漏斗活塞,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯;
⑤烧瓶中不再产生气泡时,关闭活塞;
⑥待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为100.0mL;
⑦处理剩余药品,整理实验台。
【实验分析及数据处理】
(1)加入药品前必须进行的实验①是 ;
(2)步骤④中,移走酒精灯的目的是 ;
(3)计算生成氮气的质量和密度。 (4分,计算过程中以及最终数据均保留2位小数)
【解释与结论】
1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比其他方法得到的纯氮气密度总是偏大5‰左右。若实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因是 (已知:相同条件下,气体的相对分子质量越大,密度就越大)
【反思与评价】
(1)装置中A部分的分液漏斗与蒸馏瓶之间连接的导管所起的作用是
C
防止NaNO2饱和溶液蒸发 B.保证实验装置不漏气
C.使NaNO2饱和溶液顺利滴下 D.防止溶液冲入U形管
(2)科学家瑞利仅仅是从小数点第三位数的差别,发现了新物质。这启示我们在今后的学习 和生活中要学习科学家的 .
A.严谨求实的科学态度和敢于怀疑的批判精神
B.科学研究中遇到疑惑就趁早放弃,不要浪费时间
C.不能因为微小的差异而放过一次成功的机会
D.要相信权威,权威一定是正确的