摘要: ⑴ 4.4------------------------------------------------------------------------------------1分 ⑵ 解:设所取样品中含有Na2CO3的质量为x Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑ 106 44 x 4.4g ------1分 则烧碱样品中 -------1分 答:烧碱样品中NaOH的质量分数为78.8% ⑶ 依据钠元素质量守恒关系.氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠.同时消耗98g硫酸----------------------------------------------------------- ------------1分
网址:http://m.1010jiajiao.com/timu3_id_133843[举报]
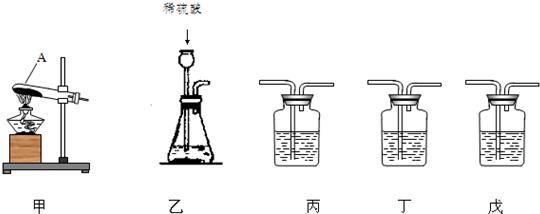
纯碱(Na2CO3)产品中常含有少量氯化钠.某厂生产的纯碱包装袋上标有“Na2CO3含量≧95%”字样.为判断该产品中Na2CO3的含量是否达到要求,称取5.0g样品进行检验,可供选取的装置如下图.其中,丙装置中装足量浓氢氧化钠溶液,丁装置中装浓硫酸,戊装置中装水.(提示:浓硫酸具有吸水性,不挥发,不与二氧化碳反应,碳酸钠受热不分解.)
(1)写出上图仪器A的一种常见用途
(2)你选择的实验装置从左到右组装排列为(填编号)
(3)假设每步都反应完全,生成的二氧化碳全部被吸收,不考虑空气中二氧化碳的影响.要较准确地计算“Na2CO3含量≧95%”是否真实,该实验除称取样品质量外,还要用天平称量得到的实验数据是
(4)若乙装置中加入浓盐酸(有挥发性),对测量结果有影响.原因是浓盐酸挥发出的氯化氢气体
(5)若实验装置连接正确,实验过程中看到丙装置出现的气泡比丁少得多,一种可能的原因是
查看习题详情和答案>>
(1)写出上图仪器A的一种常见用途
用作少量试剂的反应容器.
用作少量试剂的反应容器.
(2)你选择的实验装置从左到右组装排列为(填编号)
乙、丁、丙
乙、丁、丙
.请说出你选择或排列装置的一点理由由于是固体碳酸与液体稀硫酸反应,所以应选乙装置.
由于是固体碳酸与液体稀硫酸反应,所以应选乙装置.
.(3)假设每步都反应完全,生成的二氧化碳全部被吸收,不考虑空气中二氧化碳的影响.要较准确地计算“Na2CO3含量≧95%”是否真实,该实验除称取样品质量外,还要用天平称量得到的实验数据是
实验前后丙装置的质量
实验前后丙装置的质量
(4)若乙装置中加入浓盐酸(有挥发性),对测量结果有影响.原因是浓盐酸挥发出的氯化氢气体
随二氧化碳气体一起进入丙装置,跟氢氧化钠反应使得到的实验数据不准确.
随二氧化碳气体一起进入丙装置,跟氢氧化钠反应使得到的实验数据不准确.
(5)若实验装置连接正确,实验过程中看到丙装置出现的气泡比丁少得多,一种可能的原因是
丁装置可能漏气
丁装置可能漏气

19、已知某纯碱粗产品仅含有NaCl杂质,为测定该纯碱粗产品中纯碱的质量分数,某兴趣小组的同学设计了下图所示的实验装置,取10.0g粗产品进行实验.

说明:碱石灰是CaO与NaOH 的固体混合物.E装置中的饱和NaHCO3溶液是为了除去二氧化碳气体中的氯化氢,发生的反应为NaHCO3十HC1=NaCl十CO2↑十H2O.
实验主要操作步骤如下:
①连接好装置,检查气密性;②打开弹簧夹C,在A处缓缓通入一段时间空气;③称量 G的质量;④关闭弹簧夹C,慢慢滴加浓盐酸至过量,直至D中无气泡冒出;⑤打开弹簧夹C,再次缓缓通入一段时间空气;⑥再次称量 G的质量,得前后两次质量差为0.48g.
请回答下列问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
(2)F中的试剂应为
(3)B装置的作用是
(4)H装置的作用是
(5)事实上10.0g粗产品只能产生0.44g CO2.请你仔细分析上述实验,解释实验值
查看习题详情和答案>>

说明:碱石灰是CaO与NaOH 的固体混合物.E装置中的饱和NaHCO3溶液是为了除去二氧化碳气体中的氯化氢,发生的反应为NaHCO3十HC1=NaCl十CO2↑十H2O.
实验主要操作步骤如下:
①连接好装置,检查气密性;②打开弹簧夹C,在A处缓缓通入一段时间空气;③称量 G的质量;④关闭弹簧夹C,慢慢滴加浓盐酸至过量,直至D中无气泡冒出;⑤打开弹簧夹C,再次缓缓通入一段时间空气;⑥再次称量 G的质量,得前后两次质量差为0.48g.
请回答下列问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
样品重,砝码轻
.(2)F中的试剂应为
浓硫酸
.(3)B装置的作用是
除去空气中的二氧化碳
,B装置中发生反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O
.(4)H装置的作用是
防止空气中的二氧化碳和水蒸气被装置G中碱石灰吸收
.(5)事实上10.0g粗产品只能产生0.44g CO2.请你仔细分析上述实验,解释实验值
现欲探究一固体混合物的组成,已知其中可能含有Cu、Cu(OH)2、BaCl2、Na2CO3、Na2SO4五种物质中的两种或多种(假设所有可能发生的反应都恰好完全进行),设计实验方案如下:
第一步:取少量的固体样品放入一只烧杯中,加入足量的水充分溶解,过滤,得到无色滤液A和滤渣B.
第二步:将无色滤液A平均分成两份.
(1)向一份中滴加少量无色酚酞试液,得到红色溶液C.
(2)向另一份中滴加适量的Ba(NO3)2溶液,观察到有白色沉淀产生.然后滴加足量的稀硝酸,充分反应后,仍有部分沉淀未溶解.
第三步:向滤渣B中加入过量的稀硫酸,充分反应后过滤,得到蓝色滤液D和滤渣E.
根据以上信息,回答下列问题:
(1)滤渣E的化学式为______.
(2)滤液D中一定大量存在的阳离子______.(写离子符号)
(3)原固体混合物中一定不含有______.
(4)若向红色溶液C中滴加澄清石灰水至恰好完全反应,溶液呈______色.并解释原因:______.
(5)写出向滤液A中加Ba(NO3)2溶液的一个化学方程式______.
查看习题详情和答案>>
第一步:取少量的固体样品放入一只烧杯中,加入足量的水充分溶解,过滤,得到无色滤液A和滤渣B.
第二步:将无色滤液A平均分成两份.
(1)向一份中滴加少量无色酚酞试液,得到红色溶液C.
(2)向另一份中滴加适量的Ba(NO3)2溶液,观察到有白色沉淀产生.然后滴加足量的稀硝酸,充分反应后,仍有部分沉淀未溶解.
第三步:向滤渣B中加入过量的稀硫酸,充分反应后过滤,得到蓝色滤液D和滤渣E.
根据以上信息,回答下列问题:
(1)滤渣E的化学式为______.
(2)滤液D中一定大量存在的阳离子______.(写离子符号)
(3)原固体混合物中一定不含有______.
(4)若向红色溶液C中滴加澄清石灰水至恰好完全反应,溶液呈______色.并解释原因:______.
(5)写出向滤液A中加Ba(NO3)2溶液的一个化学方程式______.
(15分)实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题】该样品中含有那些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
则NaOH变质反应的化学方程式为 。
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和碳酸氢钠溶液中几乎不溶解。
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入 ; | 白色沉淀产生 | 该反应的化学方程式: ; |
| (2)将上述反应后的混合物过滤,取滤液加入 。 | 。 | 证明猜想Ⅱ正确 |
【实验探究2】小红同学设计如下图所示装置(铁架台略去),实验在27℃,101kPa下进行,步骤如下:
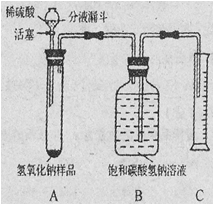
①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和碳酸氢钠溶液220mL。
请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是 ;
(2)B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由是 ;
(3)试管中原有的空气对实验结果是否有明显影响? (填“有”或“没有”)
(4)变质氢氧化钠样品中碳酸钠的质量分数为 。(在27℃,101kPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)
【提出问题3】怎样提纯该样品得到纯净的氢氧化钠固体?
【实验探究3】为得到纯净的氢氧化钠固体,小亮设计了如下图所示的实验流程。
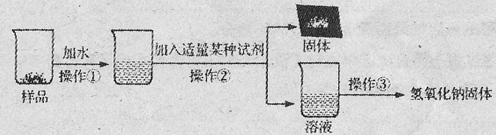
请回答下列问题:
(1)操作①、②、③的名称分别为 ,为了使样品充分溶解,操作①中还要用到的玻璃仪器是 ;
(2)该实验中发生反应的化学方程式为 ;
(3)最终所得氢氧化钠固体质量 变质后样品中氢氧化钠的质量(填“小于”、“等于”或“大于”)。
【实验反思】
(1)通过本题,你学会了定性检验氢氧化钠的变质、定量测定变质样品中某成分的含量,以及除杂提纯物质。为了得到可靠的实验结果,探究过程中你需要思考的问题有 (填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地 ④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差
(2)实验探究Ⅰ中的检验和实验探究3中的除杂都将碳酸钠进行了转化,但二者目的不同,分别是 。 查看习题详情和答案>>
(15分)实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题】该样品中含有那些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
则NaOH变质反应的化学方程式为 。
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和碳酸氢钠溶液中几乎不溶解。
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
【提出问题2】如何测量该部分变质样品中碳酸钠的质量分数?
【实验探究2】小红同学设计如下图所示装置(铁架台略去),实验在27℃,101kPa下进行,步骤如下:

①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和碳酸氢钠溶液220mL。
请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是 ;
(2)B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由是 ;
(3)试管中原有的空气对实验结果是否有明显影响? (填“有”或“没有”)
(4)变质氢氧化钠样品中碳酸钠的质量分数为 。(在27℃,101kPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)
【提出问题3】怎样提纯该样品得到纯净的氢氧化钠固体?
【实验探究3】为得到纯净的氢氧化钠固体,小亮设计了如下图所示的实验流程。

请回答下列问题:
(1)操作①、②、③的名称分别为 ,为了使样品充分溶解,操作①中还要用到的玻璃仪器是 ;
(2)该实验中发生反应的化学方程式为 ;
(3)最终所得氢氧化钠固体质量 变质后样品中氢氧化钠的质量(填“小于”、“等于”或“大于”)。
【实验反思】
(1)通过本题,你学会了定性检验氢氧化钠的变质、定量测定变质样品中某成分的含量,以及除杂提纯物质。为了得到可靠的实验结果,探究过程中你需要思考的问题有 (填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地 ④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差
(2)实验探究Ⅰ中的检验和实验探究3中的除杂都将碳酸钠进行了转化,但二者目的不同,分别是 。
【提出问题】该样品中含有那些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
则NaOH变质反应的化学方程式为 。
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和碳酸氢钠溶液中几乎不溶解。
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入 ; | 白色沉淀产生 | 该反应的化学方程式: ; |
| (2)将上述反应后的混合物过滤,取滤液加入 。 | 。 | 证明猜想Ⅱ正确 |
【实验探究2】小红同学设计如下图所示装置(铁架台略去),实验在27℃,101kPa下进行,步骤如下:

①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和碳酸氢钠溶液220mL。
请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是 ;
(2)B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由是 ;
(3)试管中原有的空气对实验结果是否有明显影响? (填“有”或“没有”)
(4)变质氢氧化钠样品中碳酸钠的质量分数为 。(在27℃,101kPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)
【提出问题3】怎样提纯该样品得到纯净的氢氧化钠固体?
【实验探究3】为得到纯净的氢氧化钠固体,小亮设计了如下图所示的实验流程。

请回答下列问题:
(1)操作①、②、③的名称分别为 ,为了使样品充分溶解,操作①中还要用到的玻璃仪器是 ;
(2)该实验中发生反应的化学方程式为 ;
(3)最终所得氢氧化钠固体质量 变质后样品中氢氧化钠的质量(填“小于”、“等于”或“大于”)。
【实验反思】
(1)通过本题,你学会了定性检验氢氧化钠的变质、定量测定变质样品中某成分的含量,以及除杂提纯物质。为了得到可靠的实验结果,探究过程中你需要思考的问题有 (填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地 ④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差
(2)实验探究Ⅰ中的检验和实验探究3中的除杂都将碳酸钠进行了转化,但二者目的不同,分别是 。