摘要:用密度为1.03 g·cm-3.质量分数为5%的食盐溶液配制成50 g质量分数为1%的食盐溶液.其操作顺序为( ) A.量取→溶解→计算 B.称量→溶解→计算 C.计算→称量→溶解 D.计算→量取→溶解 解析:首先进行计算.看需要密度为1.03 g·cm-3.质量分数为5%的食盐溶液的体积多少毫升.需要蒸馏水多少毫升(蒸馏水的密度为1 g·mol-1).然后根据计算结果进行溶液的量取.最后把量取的两液体混合.即得到50 g质量分数为1%的食盐溶液. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_131954[举报]
(1)配制50 g溶质质量分数为5%的氯化钠溶液需氯化钠________g.如图是配制的一些操作:
写出①~⑤仪器的名称:①________②________③________④________⑤________;
用序号A、B、C、D、E表示正确的实验操作顺序为________.
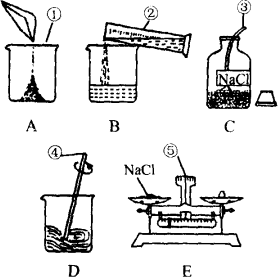
(2)如用5%的氯化钠溶液(密度为1.03 g/cm3)配制50 g 1%的氯化钠溶液,需5%的氯化钠溶液________mL,需水________mL.配制过程不必使用上图①~⑤仪器中的(填名称)________;
(3)如果所配制的溶液中氯化钠的质量分数小于5%,则可能造成误差的原因有(至少举出三点)
①________;
②________;
③________.
实验室用密度为1.84 g/cm3、质量分数为98%的浓硫酸和蒸馏水,配制500 g 质量分数
为20%的稀硫酸。需要用多少mL的量筒量取多少mL的浓硫酸?( )
A.100 mL 54.35 mL B.100 mL 55.5 mL
C.250 mL 54.35 mL D.250 mL 55.5 mL
查看习题详情和答案>>实验室用密度为1.84 g·cm-3的浓硫酸,配制500 g质量分数为20 %的稀硫酸。欲计算所需浓硫酸的体积,你认为下列说法中正确的是( )
A.还需已知水的密度为1 g·cm-3
B.还需已知20%的稀硫酸的密度为1.14 g·cm-3
C.还需已知密度为1.84 g·cm-3的浓硫酸的溶质质量分数为98%
D.题给条件充分,不需要补充其他数据
查看习题详情和答案>>