摘要:化学答案无:
网址:http://m.1010jiajiao.com/timu3_id_1237231[举报]
化学科代表和林民同学帮助实验老师整理化学药品室.发现分别放在两个试剂瓶中的两片用砂纸磨得光亮的银白色金属片,未贴上标签.到底它们是哪两种金属?两位同学首先对这两种金属X和Y的金属活动性顺序进行实验探究.
(1)进行猜想:①科代表猜想:活动性X大于Y
②林民同学猜想:活动性Y大于X
(2)设计实验方案、进行实验,获得结论.完成好如下实验报告,并回答后续有关问题.
(3)上述实验之前,实验老师只知道X、Y是银铁中的各一种,则根据实验结果说明Y就是
(4)实验老师经实验分析得知制得的Y粉末中含有未反应完的X粉末,同学们决定用化学方法将杂质X粉末除去,两个同学经讨论、交流一致认为可选用的除杂试剂是:
查看习题详情和答案>>
(1)进行猜想:①科代表猜想:活动性X大于Y
②林民同学猜想:活动性Y大于X
(2)设计实验方案、进行实验,获得结论.完成好如下实验报告,并回答后续有关问题.
| 实验步骤 | 实验现象 | 结论 |
将金属X、Y分别放入试管中, 将金属X、Y分别放入试管中, 再分别加入稀盐 再分别加入稀盐 或稀硫酸酸 或稀硫酸酸 | 金属Y表面无明显变化;金属X的表面有大量气泡冒出.将燃着的木条放在金属X的试管口,气体燃烧. | 科代表的猜想: 正确 正确 (“正确”或“不正确”) |
银或Ag
银或Ag
.实验室急需一定量的Y粉末.科代表认为可用现有的X金属粉末和Y的盐溶液、蒸馏水等药品,配以必要的仪器来制得急需的Y粉末,原因是(用反应的化学方程式表示):2AgNO3+Fe═2Ag+Fe(NO3)2
2AgNO3+Fe═2Ag+Fe(NO3)2
.(4)实验老师经实验分析得知制得的Y粉末中含有未反应完的X粉末,同学们决定用化学方法将杂质X粉末除去,两个同学经讨论、交流一致认为可选用的除杂试剂是:
盐酸(或稀硫酸)
盐酸(或稀硫酸)
.
化学老师谢××交给某研究性学习小组一个任务:测定实验室里一瓶久置的NaOH固体是否变质.该小组的同学进行了如下实验探究:
【提出问题】猜想I:没变质,全部是NaOH;
猜想II:部分变质,既含有NaOH,又含有Na2CO3;
猜想Ⅲ:完全变质,全部是Na2CO3.
【查阅资料】①已知反应:BaCl2+Na2CO3=2NaCl+BaCO3↓
②部分盐溶液在常温下的pH如下:
【设计方案并进行实验】请你与他们一起共同完成,并回答所给问题.
上述步骤①中,所用称量仪器的名称是 ,滴加过量BaCl2溶液的目的是 .
【实验结论】通过实验,说明上述猜想中 是正确的.
【拓展】该小组同学为测定出该NaOH固体的变质程度,继续将上述白色沉淀过滤、洗净、干燥,称得其质量为2.0g,则原试剂中NaOH的质量分数为 (假定试剂中无其它杂质).
【反思】久置的氢氧化钠变质的原因是 (用化学方程式表示).
查看习题详情和答案>>
【提出问题】猜想I:没变质,全部是NaOH;
猜想II:部分变质,既含有NaOH,又含有Na2CO3;
猜想Ⅲ:完全变质,全部是Na2CO3.
【查阅资料】①已知反应:BaCl2+Na2CO3=2NaCl+BaCO3↓
②部分盐溶液在常温下的pH如下:
| 盐溶液 | NaCl | Na2CO3 | BaCl2 |
| pH | 等于7 | 大于7 | 等于7 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①称取上述氢氧化钠固体样品8.0g溶于50mL水配成溶液,向溶液中滴加氯化钡溶液至过量,充分反应后,静置. | 产生白色沉淀 | 说明久置固体中,一定含有 |
| ②用玻璃棒蘸取少量①中充分反应后的上层清液滴在一小块儿pH试纸上,与标准比色卡对比,测出pH | pH=11 | 说明久置固体中,还一定含有 |
【实验结论】通过实验,说明上述猜想中
【拓展】该小组同学为测定出该NaOH固体的变质程度,继续将上述白色沉淀过滤、洗净、干燥,称得其质量为2.0g,则原试剂中NaOH的质量分数为
【反思】久置的氢氧化钠变质的原因是
化学活动小组的同学在探究金属的化学性质时,发现铜与稀硫酸在常温或短时间加热的条件下均不反应,那么铜与浓硫酸能否反应呢?
[猜想与假设]
猜想①在常温下能反应.
猜想②
猜想③
[设计方案]
①将一小块铜片放入试管中,加入浓硫酸无明显现象
②加热该试管,铜片上有气泡产生,并闻到刺激性气味
③检验产生的有刺激性气味的气体(检验方法及现象略)
④立即停止加热
⑤将试管的残液慢慢倒入少量水中,溶液呈蓝色
[结论]
(1)由以上探究可知:猜想
(2)经检验产生的气体是SO2,立即停止加热,可将多余的SO2用
(3)铜与浓硫酸在加热条件下反应的产物是SO2和CuSO4.
[反思与评价]
(1)操作⑤中,从安全角度考虑(填“能”或“不能”)
(2)探究结论中对产物是SO2和CuSO4的判断是否正确?
[拓展与应用]
根据以上探究和已掌握知识,同学们设计了两个利用废铜屑、硫酸为原料制取硫酸铜的实验方案.
甲方案:利用废铜屑与浓硫酸在加热条件下反应制取硫酸铜.
乙方案:在加热条件下将废铜屑在空气中氧化成氧化铜,再将氧化铜与稀硫酸的反应制取硫酸铜.
请你从安全、节约、环保等方面进行评价较好方案是
理由是(答一个即可)
查看习题详情和答案>>
[猜想与假设]
猜想①在常温下能反应.
猜想②
在常温下不能反应,但在加热条件下能反应
在常温下不能反应,但在加热条件下能反应
.猜想③
在加热条件下也不能反应
在加热条件下也不能反应
.[设计方案]
①将一小块铜片放入试管中,加入浓硫酸无明显现象
②加热该试管,铜片上有气泡产生,并闻到刺激性气味
③检验产生的有刺激性气味的气体(检验方法及现象略)
④立即停止加热
⑤将试管的残液慢慢倒入少量水中,溶液呈蓝色
[结论]
(1)由以上探究可知:猜想
②
②
是正确的.(2)经检验产生的气体是SO2,立即停止加热,可将多余的SO2用
氢氧化钠
氢氧化钠
溶液来吸收,反应方程式是SO2+2NaOH=Na2SO3+H2O
SO2+2NaOH=Na2SO3+H2O
.(3)铜与浓硫酸在加热条件下反应的产物是SO2和CuSO4.
[反思与评价]
(1)操作⑤中,从安全角度考虑(填“能”或“不能”)
不能
不能
将水倒入剩余的液体里,理由是如果浓硫酸有剩余,溶于水放热,比较危险
如果浓硫酸有剩余,溶于水放热,比较危险
.(2)探究结论中对产物是SO2和CuSO4的判断是否正确?
不正确
不正确
,理由是反应前后元素种类不同(或生成物中不含氢元素)
反应前后元素种类不同(或生成物中不含氢元素)
.请写出正确的铜与浓硫酸在加热条件下反应的化学方程式Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑
| ||
Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑
.
| ||
[拓展与应用]
根据以上探究和已掌握知识,同学们设计了两个利用废铜屑、硫酸为原料制取硫酸铜的实验方案.
甲方案:利用废铜屑与浓硫酸在加热条件下反应制取硫酸铜.
乙方案:在加热条件下将废铜屑在空气中氧化成氧化铜,再将氧化铜与稀硫酸的反应制取硫酸铜.
请你从安全、节约、环保等方面进行评价较好方案是
乙方案
乙方案
.理由是(答一个即可)
不产生有害气体二氧化硫
不产生有害气体二氧化硫
.化学兴趣小组同学发现实验台上按如下顺序摆放着7瓶不同的无色溶液(如图所示),其中4、5号试剂瓶标签破损.?
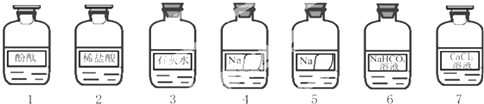
[提出问题]这两瓶试剂分别是什么??
[查阅资料]
①碱性的亚硫酸钠(Na2SO3)溶液、Na2CO3溶液都能与中性的CaCl2溶液发生复分解反应,产生白色沉淀.②Na2SO3+2HCl=2NaCl+SO2↑+H2O.?
③CO2与SO2均可以使澄清石灰水变浑浊,SO2是一种有刺激性气味的气体.?
[作出猜想]4、5号溶液可能分别是NaOH、Na2CO3、Na2SO3或NaCl溶液中的一种.
[实施方案]取少量4、5号溶液分别于试管中,然后分别进行下列三组实验.?
实验1:在两支试管中分别滴入上述七种溶液中的
实验3:在两支试管中分别滴入上述七种溶液中的2号溶液,在盛4号溶液的试管中有
[实验反思]同学们经过分析,认为4号溶液还可能是变质的NaOH溶液.请你利用上述图中的试剂设计鉴定实验方案,完成实验报告.
25.(5分)某化学兴趣小组的同学参照教科书内容,在学校实验室里完成了以下两个实验:
实验一:配制溶质质量分数为6%的NaCl溶液50g,按如下步骤进行操作:
实验二:称取5.0g粗盐进行提纯.粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质.为了有效将粗盐提纯,实验的各步操作流程如图2所示:
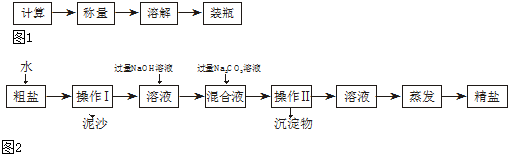
请你根据以上信息回答下述问题:
(1)配制50g溶质质量分数为6%的NaCl溶液,需NaCl
(2)NaCl溶解过程用到了玻璃棒,它的作用是
(3)粗盐提纯时,操作I的名称为
(4)某同学所得精盐比其他同学明显要少,原因可能是
A.溶解时将5.0g粗盐一次全部倒入水中,立即过滤
B.蒸发时有一些液体、固体溅出
C.提纯后所得精盐尚未完全干燥.
查看习题详情和答案>>

[提出问题]这两瓶试剂分别是什么??
[查阅资料]
①碱性的亚硫酸钠(Na2SO3)溶液、Na2CO3溶液都能与中性的CaCl2溶液发生复分解反应,产生白色沉淀.②Na2SO3+2HCl=2NaCl+SO2↑+H2O.?
③CO2与SO2均可以使澄清石灰水变浑浊,SO2是一种有刺激性气味的气体.?
[作出猜想]4、5号溶液可能分别是NaOH、Na2CO3、Na2SO3或NaCl溶液中的一种.
[实施方案]取少量4、5号溶液分别于试管中,然后分别进行下列三组实验.?
实验1:在两支试管中分别滴入上述七种溶液中的
1
1
号溶液,两试管中的溶液均变成红色,说明4、5号溶液均不可能是上述猜想中的NaCl
NaCl
溶液.?实验2:在两支试管中分别滴入上述七种溶液中的3号溶液,两试管中均产生白色沉淀,4、5号溶液可能分别是Na2SO3溶液和Na2CO3溶液中的一种.写出其中一个反应的化学方程式Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
(或Na2SO3+Ca(OH)2═CaSO3↓+2NaOH)
(或Na2SO3+Ca(OH)2═CaSO3↓+2NaOH)
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
(或Na2SO3+Ca(OH)2═CaSO3↓+2NaOH)
.(或Na2SO3+Ca(OH)2═CaSO3↓+2NaOH)
实验3:在两支试管中分别滴入上述七种溶液中的2号溶液,在盛4号溶液的试管中有
无色无味的气体产生
无色无味的气体产生
现象,说明4号是Na2CO3溶液;在盛5号溶液的试管中有刺激性气味的气体产生
刺激性气味的气体产生
现象,说明5号是Na2SO3溶液.[实验反思]同学们经过分析,认为4号溶液还可能是变质的NaOH溶液.请你利用上述图中的试剂设计鉴定实验方案,完成实验报告.
| 实验操作 | 实验现象 | 实验结论 |
4号溶液是部分变质的NaOH溶液. |
实验一:配制溶质质量分数为6%的NaCl溶液50g,按如下步骤进行操作:
实验二:称取5.0g粗盐进行提纯.粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质.为了有效将粗盐提纯,实验的各步操作流程如图2所示:

请你根据以上信息回答下述问题:
(1)配制50g溶质质量分数为6%的NaCl溶液,需NaCl
3
3
g,水47
47
mL.(2)NaCl溶解过程用到了玻璃棒,它的作用是
搅拌,加速溶解
搅拌,加速溶解
.(3)粗盐提纯时,操作I的名称为
过滤
过滤
.(4)某同学所得精盐比其他同学明显要少,原因可能是
AB
AB
.A.溶解时将5.0g粗盐一次全部倒入水中,立即过滤
B.蒸发时有一些液体、固体溅出
C.提纯后所得精盐尚未完全干燥.
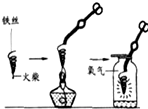 化学实验是学习化学的基础,请根据下列装置图回答问题.
化学实验是学习化学的基础,请根据下列装置图回答问题.(1)做铁丝在氧气里燃烧的实验时,应预先在盛氧气的集气瓶里装入少量的水或铺一层细沙,其目的是
防止生成物溅落炸裂瓶底
防止生成物溅落炸裂瓶底
(2)细铁丝燃烧的文字表达式是
铁+氧气
四氧化三铁
| 点燃 |
铁+氧气
四氧化三铁
.铁丝生锈是一种| 点燃 |
缓慢
缓慢
氧化.(3)小明对铁丝在氧气中燃烧为什么会火星四射的现象进行了探究.下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象的记录.请你分析并把答案填写在空格上:剧烈燃烧,火星四射
| 物质 | 镁条(不含碳) | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
| 燃烧时 的现象 |
剧烈燃烧,发出,耀眼白光,无火星 | 剧烈燃烧 极少火星 |
剧烈燃烧 少量火星 |
A |
剧烈燃烧,火星四射
剧烈燃烧,火星四射
;②铁丝在氧气中火星四射的原因:
铁丝中含有的碳引起的
铁丝中含有的碳引起的
.