摘要:26.如图是某研究性学习小组设计的实验室用足量二氧化锰与一定量浓盐酸反应制氯气的装置图.并用排饱和食盐水的方法收集氯气. 试回答下列问题: (1)请将集气瓶中导管画完整.并说明理由 , 20090505 (2)若用Ⅱ多孔球泡代替I直导管.能加快吸收氯气.其理由是 ,烧杯里废液的用途是: , (3)试用勒夏特列原理解释用饱和食盐水收集氯气的道理: , (4)收集一瓶氯气后.他们把一块干燥的蓝色石蕊试纸.放人该集气瓶中.可能观察到的现象是 .理由是 , (5)他们在实验过程中.发现有下列现象.分别指出可能的原因: ①注入浓盐酸时发现浓盐酸不能流下.可能的原因是 , ②若操作.装置没有问题.大量的盐酸与足量的二氧化锰反应.产生的氯气很少.可能原因是 , (6)为了验证反应后的剩余物质.下面是他们设计的方案.其中合理的是 .(已知:氢氧化锰性质类似于氢氧化镁性质) A.取反应后溶液.冷却.过滤.若有残渣.说明有二氧化锰剩余 B.取反应后溶液.向其中加入稀硝酸和硝酸银溶液.若有白色沉淀.则有盐酸剩余 C.取反应后溶液.向其中加人锌粒.若产生气泡.说明有盐酸剩余 D.取反应后溶液.测溶液的pH.若pH<7.则说明盐酸没有反应完 E.取反应后溶液.向溶液中加入少量碳酸氢钠粉末.若产生气泡.则说明二氧化锰已反应完
网址:http://m.1010jiajiao.com/timu3_id_1234170[举报]
如图是某研究性学习小组设计的实验室用足量二氧化锰与一定量浓盐酸反应制氯气的装置图,并用排饱和食盐水 的方法收集氯气。

试回答下列问题:
(1)请在图中将集气瓶中导管画完整。
(2)若用Ⅱ多孔球泡代替I直导管,能加快吸收氯气,其理由是______ ;
(3)试用勒夏特列原理解释用饱和食盐水收集氯气的道理______________;
(4)上图收集一瓶氯气后,他们把一块干燥的蓝色石蕊试纸,悬挂在集气瓶中,可能观察到的现象是____, 理由是____________ 。
查看习题详情和答案>>
(1)请在图中将集气瓶中导管画完整。
(2)若用Ⅱ多孔球泡代替I直导管,能加快吸收氯气,其理由是______ ;
(3)试用勒夏特列原理解释用饱和食盐水收集氯气的道理______________;
(4)上图收集一瓶氯气后,他们把一块干燥的蓝色石蕊试纸,悬挂在集气瓶中,可能观察到的现象是____, 理由是____________ 。
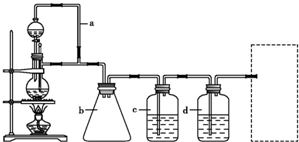
 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定该实验条件下的气体摩尔体积,设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定该实验条件下的气体摩尔体积,设计的简易实验装置如图.该实验的主要操作步骤如下:①配制浓度均为1mol/L的盐酸和醋酸溶液;
②用
酸式滴定管
酸式滴定管
量取10.00mL 1mol/L的盐酸和醋酸溶液分别加入两个锥形瓶中;③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为
0.12
0.12
;④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录
反应所需时间
反应所需时间
;⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应
将量筒缓缓向下移动,使乙、丙中液面相平
将量筒缓缓向下移动,使乙、丙中液面相平
,读出量筒中水的体积为V mL.请将上述步骤补充完整并回答下列问题:
(1)用文字表述④检查该装置气密性的操作与观察方法:
往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气;
往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气;
.(2)本实验中应选用
B
B
(填序号)的量筒.A.100mL B.200mL C.500mL
(3)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为Vm=
0.2VL/mol
0.2VL/mol
.(4)速率不等的原因是
H+浓度不同
H+浓度不同
,铜丝不与酸接触的原因是防止形成原电池,加快反应速率,干扰实验测定;
防止形成原电池,加快反应速率,干扰实验测定;
.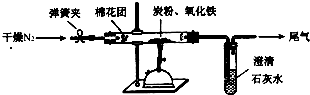 某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.(1)提出假设:①气体产物是CO2.
②气体产物是CO.
③气体产物是
(2)设计方案 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
(3)查阅资料
氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,该反应的离子方程式:
(4)实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g.
步骤②、④中都分别通入N2,其作用分别为
(5)数据处理
试根据实验数据分析判断,前面的假设
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH-CH2+CO+H2
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH-CH2+CO+H2| 一定条件 |
| H2 |
| Ni,△ |
| 浓H2SO4 |
| △ |
请填写下列空白:
(1)写出实验室制备氢气的化学方程式:
(2)若用以上装置制备干燥纯净的CO,装置中b的作用分别是
(3)制丙烯时,还产生少量SO2,CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是
①足量饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)如图所示装置工作时均与H2有关.
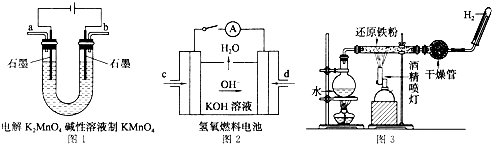
①图1所示装置中阳极的电极反应式为
②图2所示装置中,通入H2的管口是
③某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和H2.该结论
 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:Ⅰ.(1)配制浓度均为0.50mol?L-1 H2SO4和H2C2O4溶液;
(2)用
(3)分别称取除去表面氧化膜的镁条并系于铜丝末端;
(4)检查装置的气密性,在广口瓶中装满水,按图连接好装置;
(5)将铜丝向下移动,使足量镁条浸入酸中(铜丝不能与酸接触),至反应完全,记录
(6)反应结束后,读取量筒中水的体积为y mL.
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84g?cm-3 98%的浓硫酸配制250mL 0.50mol?L-1的H2SO4溶液,所需要的主要仪器有
(2)以下是读取量筒内水的体积时必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是
(4)简述速率不等的原因是