��Ŀ����
 ij�о���ѧϰС��Ϊ֤����ͬ��ͬѹ�£���ͬŨ����ͬ����IJ�ͬǿ�ȵ�һԪ��������þ����Ӧʱ�����������������ͬ����Ӧ���ʲ�ͬ��ͬʱ�ⶨ��ʵ�������µ�����Ħ���������Ƶļ���ʵ��װ����ͼ����ʵ�����Ҫ�����������£�
ij�о���ѧϰС��Ϊ֤����ͬ��ͬѹ�£���ͬŨ����ͬ����IJ�ͬǿ�ȵ�һԪ��������þ����Ӧʱ�����������������ͬ����Ӧ���ʲ�ͬ��ͬʱ�ⶨ��ʵ�������µ�����Ħ���������Ƶļ���ʵ��װ����ͼ����ʵ�����Ҫ�����������£�������Ũ�Ⱦ�Ϊ1mol/L������ʹ�����Һ��
����
��ʽ�ζ���
��ʽ�ζ���
��ȡ10.00mL 1mol/L������ʹ�����Һ�ֱ����������ƿ�У��۷ֱ��ȡ��ȥ��������Ĥ��þ��a g����ϵ��ͭ˿ĩ�ˣ�a����ֵ����Ϊ
0.12
0.12
�����ڹ��ƿ��װ������ˮ����ͼ���Ӻ�װ�ã����װ�õ������ԣ�
�ݽ�ͭ˿�����ƶ���ʹ����þ���������У�ͭ˿������Ӵ���������Ӧ��ȫ����¼
��Ӧ����ʱ��
��Ӧ����ʱ��
����Ӧ��������¶Ȼָ������£�������Һ���������Һ�棬��ȡ��Ͳ��ˮ�����ǰ��Ӧ
����Ͳ���������ƶ���ʹ�ҡ�����Һ����ƽ
����Ͳ���������ƶ���ʹ�ҡ�����Һ����ƽ
��������Ͳ��ˮ�����ΪV mL���뽫�������貹���������ش��������⣺
��1�������ֱ����ܼ���װ�������ԵIJ�����۲췽����
�����м�ˮû�������ܿ��¶ˣ������ƽ��������һ��������۲쵽���е�����ð���ݣ�����װ�ò�©����
�����м�ˮû�������ܿ��¶ˣ������ƽ��������һ��������۲쵽���е�����ð���ݣ�����װ�ò�©����
����2����ʵ����Ӧѡ��
B
B
������ţ�����Ͳ��A��100mL��B��200mL��C��500mL
��3����ˮ������Ӱ����Բ��ƣ���ʵ���������£�����Ħ������ļ���ʽΪVm=
0.2VL/mol
0.2VL/mol
����4�����ʲ��ȵ�ԭ����
H+Ũ�Ȳ�ͬ
H+Ũ�Ȳ�ͬ
��ͭ˿������Ӵ���ԭ������ֹ�γ�ԭ��أ��ӿ췴Ӧ���ʣ�����ʵ��ⶨ��
��ֹ�γ�ԭ��أ��ӿ췴Ӧ���ʣ�����ʵ��ⶨ��
���������ڸ�����ʽ�ζ��ܺͼ�ʽ�ζ��ܵ�ʹ��Ҫ���Լ���ȷ����ѡ��
�۸��ݻ�ѧ����ʽ���м��㣻
�ݱȽϻ�ѧ��Ӧ���ʣ������DZȽ�һ��ʱ��֮�ڵķ�Ӧ��Ũ�ȵı仯���������ı仯����3������ʱҪ������������ѹǿ��ȣ��Լ�����
����ʱҪ������������ѹǿ��ȣ��Լ�����
��1���Ӽ��װ�õ������Ե�ԭ�������ǣ�
��2�����ݻ�ѧ����ʽ���м��㣻
��3����������Ħ�����Vm=
��������
��4����Ӱ�컯ѧ��Ӧ���ʵ�����������������þ��ͭ���γ�ԭ��أ��ӿ췴Ӧ���ʣ�����ʵ��ⶨ��
�۸��ݻ�ѧ����ʽ���м��㣻
�ݱȽϻ�ѧ��Ӧ���ʣ������DZȽ�һ��ʱ��֮�ڵķ�Ӧ��Ũ�ȵı仯���������ı仯����3������ʱҪ������������ѹǿ��ȣ��Լ�����
����ʱҪ������������ѹǿ��ȣ��Լ�����
��1���Ӽ��װ�õ������Ե�ԭ�������ǣ�
��2�����ݻ�ѧ����ʽ���м��㣻
��3����������Ħ�����Vm=
| V |
| n |
��4����Ӱ�컯ѧ��Ӧ���ʵ�����������������þ��ͭ���γ�ԭ��أ��ӿ췴Ӧ���ʣ�����ʵ��ⶨ��
����⣺������Ҫ��������10.00 mL�Ͼ�ȷ��Ӧѡ��ʽ�ζ��ܣ����ü�ʽ�ζ��ܻḯʴ�ܣ��ʴ�Ϊ����ʽ�ζ��ܣ�
��Mg+2HCl����HAc���TMgCl2+H2��
24g�� 2 mol����������������
a 1mol/L��0.01L����
a=0.12 g��
�ʴ�Ϊ��0.12��
�ݱȽϻ�ѧ��Ӧ���ʣ������DZȽ�һ��ʱ��֮�ڵķ�Ӧ��Ũ�ȵı仯���������ı仯���ʴ�Ϊ����Ӧ����ʱ�䣻
����ʱҪ������������ѹǿ��ȣ��Լ������ʴ�Ϊ������Ͳ���������ƶ���ʹ�ҡ�����Һ����ƽ��
��1���粻©��������ʱ������ѹǿ����������ð�����ʴ�Ϊ�������м�ˮû�������ܿ��¶ˣ������ƽ��������һ��������۲쵽���е�����ð���ݣ�����װ�ò�©����
��2��Mg+2HCl����HAc���TMgCl2+H2��
�� 2 mol������������������1 mol
�� 1 mol/L��0.01 L���� n��H2��
n��H2��=0.005 mol��V��H2��=0.005 mol��22.4L/mol=0.112L=112ml��Ӧѡ200 mL��Ͳ���ʴ�Ϊ��B��
��3���ɣ�2������������ʵ���Ϊ0.005 mol��ͨ������������ΪV mL��Vm=
=
=0.2V L/mol���ʴ�Ϊ��0.2VL/mol��
��4��Ӱ�컯ѧ��Ӧ���ʵ�������Ũ�ȡ��¶ȡ�ѹǿ�ȣ�����ΪŨ�Ȳ�ͬ���ʴ�Ϊ��H+Ũ�Ȳ�ͬ��
þ��ͭ���γ�ԭ��أ��ӿ췴Ӧ���ʣ�����ʵ��ⶨ������ͭ˿������Ӵ����ʴ�Ϊ����ֹ�γ�ԭ��أ��ӿ췴Ӧ���ʣ�����ʵ��ⶨ��
��Mg+2HCl����HAc���TMgCl2+H2��
24g�� 2 mol����������������
a 1mol/L��0.01L����
a=0.12 g��
�ʴ�Ϊ��0.12��
�ݱȽϻ�ѧ��Ӧ���ʣ������DZȽ�һ��ʱ��֮�ڵķ�Ӧ��Ũ�ȵı仯���������ı仯���ʴ�Ϊ����Ӧ����ʱ�䣻
����ʱҪ������������ѹǿ��ȣ��Լ������ʴ�Ϊ������Ͳ���������ƶ���ʹ�ҡ�����Һ����ƽ��
��1���粻©��������ʱ������ѹǿ����������ð�����ʴ�Ϊ�������м�ˮû�������ܿ��¶ˣ������ƽ��������һ��������۲쵽���е�����ð���ݣ�����װ�ò�©����
��2��Mg+2HCl����HAc���TMgCl2+H2��
�� 2 mol������������������1 mol
�� 1 mol/L��0.01 L���� n��H2��
n��H2��=0.005 mol��V��H2��=0.005 mol��22.4L/mol=0.112L=112ml��Ӧѡ200 mL��Ͳ���ʴ�Ϊ��B��
��3���ɣ�2������������ʵ���Ϊ0.005 mol��ͨ������������ΪV mL��Vm=
| V |
| n |
| 0.001V |
| 0.005 |
��4��Ӱ�컯ѧ��Ӧ���ʵ�������Ũ�ȡ��¶ȡ�ѹǿ�ȣ�����ΪŨ�Ȳ�ͬ���ʴ�Ϊ��H+Ũ�Ȳ�ͬ��
þ��ͭ���γ�ԭ��أ��ӿ췴Ӧ���ʣ�����ʵ��ⶨ������ͭ˿������Ӵ����ʴ�Ϊ����ֹ�γ�ԭ��أ��ӿ췴Ӧ���ʣ�����ʵ��ⶨ��
����������Ϊʵ��̽���⣬ע��ʵ�����������ע�����֪ʶ�����գ��Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
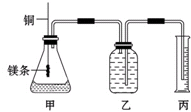 ij�о���ѧϰС��Ϊ֤����ͬ��ͬѹ�£���ͬŨ����ͬ����IJ�ͬǿ�ȵ�һԪ��������þ��Ӧʱ�����������������ͬ����Ӧ���ʲ�ͬ��ͬʱ�ⶨʵ���������µ�����Ħ���������Ƶļ���ʵ��װ����ͼ����ʵ�����Ҫ�����������£�
ij�о���ѧϰС��Ϊ֤����ͬ��ͬѹ�£���ͬŨ����ͬ����IJ�ͬǿ�ȵ�һԪ��������þ��Ӧʱ�����������������ͬ����Ӧ���ʲ�ͬ��ͬʱ�ⶨʵ���������µ�����Ħ���������Ƶļ���ʵ��װ����ͼ����ʵ�����Ҫ�����������£�
