摘要:食盐是日常生活的必需品.也是重要的化工原料. (1)粗食盐常含有少量K+.Ca2+.Mg2+.Fe3+.SO42-等杂质离子,实验室提纯NaCl的流程如下: 提供的试剂:饱和Na2CO3溶液.饱和K2CO3溶液.NaOH溶液.BaCl2溶液.Ba(NO3)2溶液.75%乙醇.四氯化碳 ①欲除去溶液I中的Ca2+.Mg2+.Fe3+.SO42-.选出a所代表的试剂.按滴加顺序依次为 . ②洗涤除去NaCl晶体表面附带的少量KCl.选用的试剂为 . (2)用提纯的NaCl配制500mL 4.00 mol·L-1的NaCl溶液.所用仪器除药匙.玻璃棒外还有 . (3)电解饱和食盐水的装置如图所示.若收集的H2为2L.则同样条件下收集的Cl2 (填“> “= 或“< )2L.原因是 .装置改进后.可用于制备NaOH溶液.若测定溶液中NaOH的浓度.常用的方法为 . (4)实验室制备H2和Cl2通常采用下列反应:Zn + H2SO4 ZnSO4 + H2↑, MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O.据此.从下列所给仪器装置中选择制备并收集H2的装置 和制备并收集干燥.纯净Cl2的装置 . 可选用制备气体的装置:
网址:http://m.1010jiajiao.com/timu3_id_1233312[举报]
食盐是日常生活的必需品,也是重要的化工原料.一同学用某种粗盐进行提纯实验,步骤如图所示.
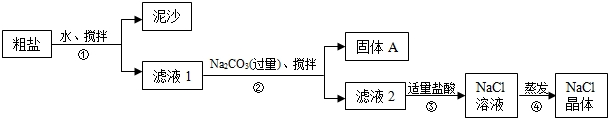
请回答:
(1)步骤①和②的操作名称是 .
(2)步骤②中为得到纯净的固体A,需将沉淀A用水洗涤干净,请设计实验检验沉淀A是否洗净 .
(3)猜想和验证:
(4)我省生产的某种钙盐的配料表如下:氯化钠、食用碳酸钙、碘酸钾.为了测定此盐中的钙元素含量,取10g这种盐溶于水,加入足量盐酸,生成0.132g二氧化碳.请计算此加钙食盐中钙元素的质量分数.
查看习题详情和答案>>

请回答:
(1)步骤①和②的操作名称是
(2)步骤②中为得到纯净的固体A,需将沉淀A用水洗涤干净,请设计实验检验沉淀A是否洗净
(3)猜想和验证:
| 猜想 | 验证方法 | 实验现象 | 结论 |
| 猜想I:固体A中含有CaCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | ___________ | 猜想I成立 |
| 猜想II:固体A中含有BaCO3 |
取少量固体A于试管中,先滴入_________,再滴入稀Na2SO4溶液 | 有气泡放出,无白色沉淀 | ________ |
| 猜想III:最后制得的NaCl晶体中还含有Na2SO4 |
取少量NaCl晶体于试管中,加适量的蒸馏水溶解,再_______ | ________ | 猜想III成立 |
食盐是日常生活的必需品,也是重要的化工原料.一同学用某种粗盐进行提纯实验,步骤如图所示.
请回答:
(1)步骤①和②的操作名称是
(2)步骤④加热蒸发时要用到玻璃棒不断搅拌,这是为了防止
(3)猜想和验证:
(4)我省生产的某种钙盐的配料表如下:氯化钠、食用碳酸钙、碘酸钾.为了测定此盐中的钙元素含量,取10g这种盐溶于水,加入足量盐酸,生成0.132g二氧化碳.请计算此加钙食盐中钙元素的质量分数.
查看习题详情和答案>>

请回答:
(1)步骤①和②的操作名称是
过滤
过滤
.(2)步骤④加热蒸发时要用到玻璃棒不断搅拌,这是为了防止
溶液局部过热而飞溅
溶液局部过热而飞溅
.(3)猜想和验证:
| 猜想 | 验证方法 | 实验现象 | 结论 |
| 猜想Ⅰ:固体A中含 CaCO3 |
取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | 有气泡产生,石灰水变浑浊 有气泡产生,石灰水变浑浊 |
猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含 BaCO3 |
取少量固体A于试管中,先滴入 稀盐酸 稀盐酸 ,再滴入Na2SO4溶液 |
有气泡放出,无白色沉淀 | 猜想Ⅱ不成立 猜想Ⅱ不成立 |
| 猜想Ⅲ:最后制得的 NaCl晶体中还含有Na2SO4 |
取少量NaCl晶体于试管中,加适量蒸馏水溶解,再 加BaCl2 加BaCl2 |
有白色沉淀生成 有白色沉淀生成 |
猜想Ⅲ成立 |