网址:http://m.1010jiajiao.com/timu3_id_1230851[举报]
(1)E2F的水溶液呈
(2)工业上电解EG的水溶液的离子化学方程式是:
(3)1molFD2在一定条件下与D2完全反应生成气态化合物放出98.3KJ热量,写出其热化学方程式:
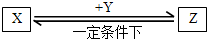
(4)下列变化中(如图)的物质均为上述七种元素间形成的单质或化合物间的变化,某些反应条件及某些物质已略去,请按要求写一例化学方程式或回答有关问题.
①若X、Y均为气态氢化物,则X与Y反应的化学方程式是
②若X、Y均为组成元素相同的酸式盐,则X与Y反应的化学方程式是
③若X、Y均不属于盐类,但两者组成元素相同(均含四种元素),其相对分子质量之差为14,且两者既能与NaOH溶液反应,又能与盐酸反应.则X、Y中相对分子质量最小的物质是
现有原子序数依次增大的A、B、C、D、E五种短周期元素.已知A、C、D三种原子的最外层电子数之和为10,这三种元素的最高价氧化物对应的水化物之间,两两皆能反应;D元素的最高正价与最低负价的代数和为4.请填写下列空白:
(1)A元素的一种氧化物中组成元素的原子个数比为1∶1,该氧化物与水反应的化学方程式为________,该反应中水________(从下列选项中选择,填序号).
A.是氧化剂
B.是还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂
(2)B元素在元素周期表中的位置是________;B的单质在二氧化碳中燃烧的化学方程式是________.
(3)写出A、C两元素的最高价氧化物对应的水化物之间反应的离子方程式:____________.
(4)D元素的最高价氧化物对应的水化物是________(填化学式),其浓溶液具有脱水性、吸水性和强________性等特性.
(5)在汶川地震灾区大量使用的一种环境消毒剂是通过将E的单质通入石灰乳中制得的,写出该反应化学方程式____________.
(6)能说明元素E的非金属性强于D的事实有(用简要文字或化学用语回答,写出其中2条):___________________.
(1)B在周期表中的位置是:
(2)根据等电子原理分析,BC2 +中B原子的轨道杂化类型是
(3)五种元素中,电负性最大与最小的两种非金属元素形成的化合物在常温下是晶体,其晶体类型是
(4)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测D元素的电离能突增应出现在第
(5)A的一种相对分子质量为28的氢化物,其分子中σ键与π键的个数之比为
(6)E的基态原子有

(15分)原子序数依次递增的A、B、C、D、E是周期表中前30号元素。已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个。请回答下列问题:
(1)B在周期表中的位置是: ,该主族元素的气态氢化物中,沸点最低的是 (填化学式)。
(2)根据等电子原理分析,BC2 + 中B原子的轨道杂化类型是 。
(3)五种元素中,电负性最大与最小的两种非金属元素形成的化合物在常温下是晶体,其晶体类型是 。
(4)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测D元素的电离能突增应出现在第 电离能。
(5)A的一种相对分子质量为28的氢化物,其分子中σ键与π键的个数之比为 ;;
(6)E的基态原子有 种形状不同的原子轨道;E2+ 的价电子排布式为 ;下
图(填甲、乙或丙) 表示的是E晶体中微粒的堆积方式。



甲 乙 丙
查看习题详情和答案>>
(1)B在周期表中的位置是: ,该主族元素的气态氢化物中,沸点最低的是 (填化学式)。
(2)根据等电子原理分析,BC2+ 中B原子的轨道杂化类型是 。
(3)五种元素中,电负性最大与最小的两种非金属元素形成的化合物在常温下是晶体,其晶体类型是 。
(4)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测D元素的电离能突增应出现在第 电离能。
(5)A的一种相对分子质量为28的氢化物,其分子中σ键与π键的个数之比为 ;;
(6)E的基态原子有 种形状不同的原子轨道;E2+ 的价电子排布式为 ;下
图(填甲、乙或丙) 表示的是E晶体中微粒的堆积方式。



甲 乙 丙