摘要:A.B.C.D.E.F六种短周期元素的原子序数依次增大.已知A元素原子最外电子层上的电子数是其电子层数的2倍.B元素是植物生长的重要营养元素.C.D.F三原子的最外层共有11个电子.且这三种元素的最高价氧化物的水化物之间两两皆能反应.均生成盐和水.E与A是同主族元素.试回答: (1) A的元素符号 .F元素原子的结构示意图 . (2) 最近科学家们合成了B5n+,电子式为 则n值为 . (3)实验室制取F2的化学方程式是 . (4)C和D两种元素最高价氧化物的水化物之间反应的离子方程式是 . (5)比较A的固态氧化物和E的固态氧化物的沸点.较高者是 ,其原因是 . (6)用多孔的石墨电极电解滴有酚酞的C和F形成的化合物的饱和溶液500mL时.两极共产生气体1120mL.则溶液的pH= .(假设溶液体积不变.温度为常温)
网址:http://m.1010jiajiao.com/timu3_id_1229362[举报]
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,在所有元素中A的原子半径最小,B原子最外层电子数是次外层的2倍.A、E同主族,D、F同主族,且D、F的原子序数之和为A、E的原子序数之和的2倍,请回答下列问题:
(1)写出下列元素的名称:C
(2)A、C能形成多种化合物,其中C2A4的结构式为
 (用元素符号回答,下同);
(用元素符号回答,下同);
(3)化合物E2D2中存在的化学键类型为
(4)由A、D、E、F四种元素形成的两种化合物,在水溶液中两者反应的离子方程式为
(5)B的单质可与A、D、F形成化合物的浓溶液反应,为检验所有生成物,被检验物质的顺序依次为
查看习题详情和答案>>
(1)写出下列元素的名称:C
氮
氮
;E钠
钠
;(2)A、C能形成多种化合物,其中C2A4的结构式为


(3)化合物E2D2中存在的化学键类型为
离子键、非极性键
离子键、非极性键
;(4)由A、D、E、F四种元素形成的两种化合物,在水溶液中两者反应的离子方程式为
H++HSO3-═H2O+SO2↑
H++HSO3-═H2O+SO2↑
;(5)B的单质可与A、D、F形成化合物的浓溶液反应,为检验所有生成物,被检验物质的顺序依次为
H2O、SO2、CO2
H2O、SO2、CO2
.A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.
则:
(1)B的原子结构示意图为
 .
.
(2)B、C、E分别与A形成的化合物中最稳定的是
(3)C与D形成的化合物的化学式是
(4)F的单质在反应中常作
查看习题详情和答案>>
| 元素 | 信息 |
| B | 其单质在常温下为双原子分子,与A可形成分子X,X的水溶液呈碱性 |
| D | 其简单阳离子与X具有相同电子数,且是同周期中简单阳离子中半径最小的 |
| E | 元素原子最外层比次外层少2个电子 |
| C、F | 两种元素的原子最外层共有13个电子 |
(1)B的原子结构示意图为


(2)B、C、E分别与A形成的化合物中最稳定的是
H2O
H2O
(写化学式).(3)C与D形成的化合物的化学式是
Al2O3
Al2O3
,它的性质决定了它在物质的分类中应属于两性氧化物
两性氧化物
;请写出该化合物对应水化物电离的方程式Al3++3OH-?Al(OH)3?AlO2-+H++H2O
Al3++3OH-?Al(OH)3?AlO2-+H++H2O
.(4)F的单质在反应中常作
氧化
氧化
剂,该单质的水溶液与E的低价氧化物反应的离子方程式为Cl2+SO2+2H2O═4H++2Cl-+SO4 2-
Cl2+SO2+2H2O═4H++2Cl-+SO4 2-
.A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次外层电子数多4个;④D原子的次外层电子数是最外层电子数的8倍;⑤E单质既能和盐酸反应又能和烧碱反应;⑥F与C同主族.用化学符号或化学用语回答下列问题:
(1)用电子式表示下列物质A2C2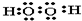
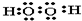 ,DCA
,DCA
 ;
;
(2)用电子式表示D与F形成化合物的过程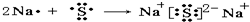
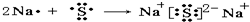 ;
;
(3)用“化学式”和“<或>”比较:A与C、A与F形成化合物的稳定性
(4)写出E与烧碱反应的离子方程式
查看习题详情和答案>>
(1)用电子式表示下列物质A2C2
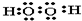
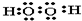


(2)用电子式表示D与F形成化合物的过程
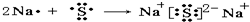
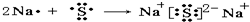
(3)用“化学式”和“<或>”比较:A与C、A与F形成化合物的稳定性
H2O>H2S
H2O>H2S
;沸点的高低H2O>H2S
H2O>H2S
,沸点高低的原因H2O分子间存在氢键
H2O分子间存在氢键
;(4)写出E与烧碱反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.期中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子.
回答下列问题:
(1)C与D形成的化合物的化学式是
(2)将X气体通入A与F形成的化合物的水溶液中,使之恰好完全反应.此时溶液呈
(3)F的单质在反应中常作
(4)写出X分子的等电子体(原子数和电子数均相等的粒子)
 (用电子式表示),并写出该等电子体与X溶液反应的离子方程式:
(用电子式表示),并写出该等电子体与X溶液反应的离子方程式:
查看习题详情和答案>>
回答下列问题:
(1)C与D形成的化合物的化学式是
Al2O3
Al2O3
,它的性质决定了它在物质的分类中应属于两性氧化物
两性氧化物
;该化合物的水化物的电离方程式是H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-
 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-
. Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-(2)将X气体通入A与F形成的化合物的水溶液中,使之恰好完全反应.此时溶液呈
酸
酸
性,(填“酸”、“碱”、中”);溶液中离子浓度由大到小的顺序为Cl->NH4+>H+>OH-
Cl->NH4+>H+>OH-
.(3)F的单质在反应中常作
氧化剂
氧化剂
剂,该单质的水溶液与E的低价氧化物反应的化学方程式是Cl2+SO2+2H2O═2HCl+H2SO4
Cl2+SO2+2H2O═2HCl+H2SO4
.(4)写出X分子的等电子体(原子数和电子数均相等的粒子)


NH3?H2O+H3O+═2H2O+NH4+
NH3?H2O+H3O+═2H2O+NH4+
.A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.请回答:
(1)元素C在周期表中的位置是
(2)元素D的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,这种化合物与水反应的离子方程式
(3)D和E两种元素相比较,其原子得电子能力较强的是
以下说法中,可以证明上述结论的是
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素氢化物的水溶液的酸性
(4)元素A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中反应的离子方程式是:
(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y.在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X
(6)元素F的单质常温下是一种气体,工业上主要是通过电解其钠盐的饱和溶液的方法获得该气体,假定装入的饱和溶液为100mL(电解前后溶液体积变化可忽略),当测得阴极上产生11.2mL(标准状况)气体时停止通电,将溶液摇匀,此时溶液的pH为
查看习题详情和答案>>
(1)元素C在周期表中的位置是
第二周期第ⅣA族
第二周期第ⅣA族
.(2)元素D的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,这种化合物与水反应的离子方程式
2Na2O2 +2H2 O=4Na++4OH-+O2↑
2Na2O2 +2H2 O=4Na++4OH-+O2↑
.(3)D和E两种元素相比较,其原子得电子能力较强的是
氧
氧
(写名称).以下说法中,可以证明上述结论的是
bc
bc
(填写编号).a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素氢化物的水溶液的酸性
(4)元素A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中反应的离子方程式是:
HSO3-+H+=SO2↑+H2O
HSO3-+H+=SO2↑+H2O
.(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y.在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X
>
>
Y(填“>”、“=”或“<”)(6)元素F的单质常温下是一种气体,工业上主要是通过电解其钠盐的饱和溶液的方法获得该气体,假定装入的饱和溶液为100mL(电解前后溶液体积变化可忽略),当测得阴极上产生11.2mL(标准状况)气体时停止通电,将溶液摇匀,此时溶液的pH为
12
12
.