摘要:混合物是由两种或多种物质混合而成的.这些物质之间没有发生反应.各自保持着原来的性质.如空气中的氮气和氧气.
网址:http://m.1010jiajiao.com/timu3_id_116070[举报]
由两种或多种物质混合而成的物质是________,这些物质之间________发生反应,各自________着各自的性质.纯净物由________物质组成,例如________,纯净物有固定的________和确定的________.
查看习题详情和答案>>图1是甲、乙两种物质的溶解度曲线,图2所示两个烧杯中各盛有20℃时上述两种物质的饱和溶液。请你通过分析,回答下列问题:
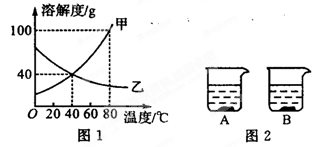
(1)溶解度随温度升高而增大的物质是 (填“甲”或“乙”);
(2)80℃时,100 g水中最多可溶解甲物质 g,该饱和溶液中溶质的质量分数为 。
(3)当温度由20℃升高至60℃时(不考虑水分蒸发),B烧杯中固体质量增加,则B烧杯溶液中的溶质是 (填“甲”或“乙”)。
(4)由图1分析,若分别将200 g甲、乙的饱和溶液从80℃降温到40℃,对所得溶液的叙述正确的是 (填序号)。
A.甲、乙都是饱和溶液 B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙 D.溶质质量分数:甲>乙
(5)甲中混有少量乙,如果要提纯甲,分离的实验操作步骤主要有:①称量需提纯的固体混合物;②控制水量,配制成80℃左右的饱和溶液; ③降温至20℃后进行过滤,并用少量冷水洗涤过滤器中的固体2-3次;④取出固体,干燥、包装。
请回答:步骤③中,过滤后,需进行洗涤,目的是 。
不用热水而用冷水洗涤的原因是 。
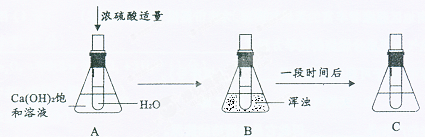
(6)有同学做了以下实验,请仔细观察下图中实验过程和溶液的变化并回答问题。
在A、B、C 中Ca(OH)2 溶液的溶质质量分数的大小关系是 。

(1)溶解度随温度升高而增大的物质是 (填“甲”或“乙”);
(2)80℃时,100 g水中最多可溶解甲物质 g,该饱和溶液中溶质的质量分数为 。
(3)当温度由20℃升高至60℃时(不考虑水分蒸发),B烧杯中固体质量增加,则B烧杯溶液中的溶质是 (填“甲”或“乙”)。
(4)由图1分析,若分别将200 g甲、乙的饱和溶液从80℃降温到40℃,对所得溶液的叙述正确的是 (填序号)。
A.甲、乙都是饱和溶液 B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙 D.溶质质量分数:甲>乙
(5)甲中混有少量乙,如果要提纯甲,分离的实验操作步骤主要有:①称量需提纯的固体混合物;②控制水量,配制成80℃左右的饱和溶液; ③降温至20℃后进行过滤,并用少量冷水洗涤过滤器中的固体2-3次;④取出固体,干燥、包装。
请回答:步骤③中,过滤后,需进行洗涤,目的是 。
不用热水而用冷水洗涤的原因是 。
(6)有同学做了以下实验,请仔细观察下图中实验过程和溶液的变化并回答问题。
在A、B、C 中Ca(OH)2 溶液的溶质质量分数的大小关系是 。

(2012?市中区三模)实验室中现有一种固体混合物,其中可能含有Na2SO4、BaCl2、(NH4)2SO4、CuO、Na2CO3五种物质中的两种或多种.按如图所示进行实验,出现的现象如图中所述(设过程中所有可能发生的反应都恰好完全进行).
试根据实验过程和发生的现象判断: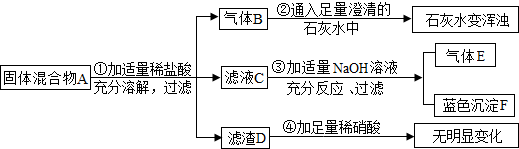
(1)气体B能使紫色的石蕊试液变
(2)在混合物A中,一定存在的物质有
(3)在溶液C中,一定大量存在的阳离子是
(4)写出步骤③中一定发生的一个化学反应的方程式
(5)滤渣D是(写化学式)
(6)固体混合物里,上述五种物质中,还不能确定存在的物质是(写化学式)
查看习题详情和答案>>
试根据实验过程和发生的现象判断:

(1)气体B能使紫色的石蕊试液变
红色
红色
色.(2)在混合物A中,一定存在的物质有
4
4
种.(3)在溶液C中,一定大量存在的阳离子是
Cu2+、NH4+
Cu2+、NH4+
.(4)写出步骤③中一定发生的一个化学反应的方程式
CuCl2+2NaOH═Cu(OH)2↓+2NaCl
CuCl2+2NaOH═Cu(OH)2↓+2NaCl
.(5)滤渣D是(写化学式)
BaSO4
BaSO4
.(6)固体混合物里,上述五种物质中,还不能确定存在的物质是(写化学式)
Na2SO4
Na2SO4
,得此结论的理由是因为滤渣D是BaSO4,而氯化钡和硫酸钠或硫酸铵都能生成该沉淀,故到底是有硫酸铵一种,还是两者都有无法确定
因为滤渣D是BaSO4,而氯化钡和硫酸钠或硫酸铵都能生成该沉淀,故到底是有硫酸铵一种,还是两者都有无法确定
. 23、海洋是巨大的资源宝库,从海洋中可提取许多重要物质.请你参与下列探究活动并完成有关问题:
23、海洋是巨大的资源宝库,从海洋中可提取许多重要物质.请你参与下列探究活动并完成有关问题:(1)我市某盐场测得:
①海水含NaCl约为3.5%;(即指溶质氯化钠的质量占整个溶液中质量的百分比为3.5%,下同);
②在海边打深井,井水中含NaCl约为8%.
晒盐最好选择
②
(填序号)作原料,理由是井水中NaCl的质量分数较大,经土层过滤后污染小
.(2)关于晒盐原理的说法正确的是
B
.A.利用阳光和风力,使氯化钠蒸发出来
B.利用阳光和风力,使水分蒸发,析出食盐
C.降低温度使氯化钠析出
D.日光照晒后,氯化钠的溶解度变小
(3)晒盐后得到的母液(又称卤水)中含有氯化镁(MgCl2)、硫酸镁(MgSO4)和氯化钾(KCl)等物质.参照图中各物质的溶解度曲线,从卤水中提取氯化钾晶体可采用下列方法:
①将卤水加热到60℃以上蒸发水分后,会逐渐析出
硫酸镁
(填名称)晶体,其理由是硫酸镁温度高于60℃后硫酸镁的溶解度随温度升高而减小,在三种物质中溶解度最低
.②将①中的晶体过滤后,得到滤液,把滤液降温至30℃以下,又析出氯化钾晶体,然后用少量的
冷水
(填“热水”或“冷水”)洗涤这两种晶体的混合物,就可以得到较纯的氯化钾晶体.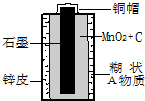 随意丢弃废旧干电池会造成环境污染,而废旧干电池中的许多物质都是可以回收利用的.下面是某化学兴趣小组探究废旧干电池的过程,请帮助他们完成相应的报告:
随意丢弃废旧干电池会造成环境污染,而废旧干电池中的许多物质都是可以回收利用的.下面是某化学兴趣小组探究废旧干电池的过程,请帮助他们完成相应的报告:【提出问题】废旧干电池的组成物质有什么?
【探究活动1】电池中含有的材料有哪些?请各举一例:金属
【探究活动2】电池内白色糊状物是由什么物质组成的?
【猜想1】甲同学在剥开电池锌壳时,闻到一股淡淡的刺激性气味,因此,电池的白色糊状物中含有NH4+.
【设计方案1】取少量白色糊状物与NaOH固体混合置于试管中,加热,用湿润的红色石蕊试纸置于试管
口,观察到试纸变蓝,证明上述猜想正确.
【猜想2】乙同学认为可能含有OH-、CO32-、Cl-、SO42-中的一种或几种,并需检验白色糊状物.
【设计方案2】为了验证猜想2,设计如下实验,请完成表格中相应内容.
| 操作步骤 | 实验现象 | 相应的结论 |
| 1.取样.溶于适量的水,静置,过滤.取少量滤液于一支试管中,滴加紫色石蕊试液. | 石蕊试液不变蓝色 | |
| 2.另取少量滤液于另一支试管中,滴加稍过量的稀硝酸. | 无明显现象 | 没有 |
| 3.再向第2步所得溶液中继续滴加少量的 |
没有SO42-存在 | |
| 4.向第3步所得溶液中再滴加少量硝酸银溶液 | 有白色沉淀产生 | 有 |
| 5.取白色糊状物,滴加少量碘溶液 | 有蓝色出现 | 有 |
【交流与讨论】通过探究,你认为电池内的白色糊状物有无回收价值?
【探究活动3】利用回收的废旧电池制取ZnSO4晶体.
【实验步骤】(根据流程提示,填写空格内的内容.)
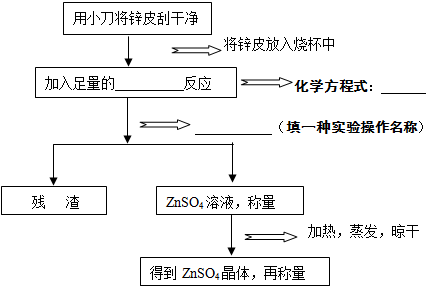
【数据处理】丙同学测量的实验数据如下表:
| 废电池1个 | 蒸发皿 | 蒸发皿+ZnSO4溶液 | 蒸发皿+ZnSO4晶体 | |
| 质量/g | 80 | 46.5 | 225.5 | 62.6 |