摘要:置换反应.化学能2.2H2O2 2H2O+O2 分解反应,S+O2 SO2 明亮的蓝紫色火焰,CO+CuO Cu+CO2 CO
网址:http://m.1010jiajiao.com/timu3_id_115142[举报]
 “化学多米诺实验”是利用化学反应中气体产生的压力,使多个化学反应依次发生(整个反应只需要第一个反应发生,就好像多米诺骨牌游戏一样).以下就是一个“化学多米诺实验”,已知H2O2在MnO2的催化作用下可分解产生O2和H2O.如图所示的A-H各装置中分别盛放的物质为:
“化学多米诺实验”是利用化学反应中气体产生的压力,使多个化学反应依次发生(整个反应只需要第一个反应发生,就好像多米诺骨牌游戏一样).以下就是一个“化学多米诺实验”,已知H2O2在MnO2的催化作用下可分解产生O2和H2O.如图所示的A-H各装置中分别盛放的物质为:A、稀硫酸;B、锌粒;C、3%H2O2溶液;D、MnO2;E、某溶液;F、某块状固体;G、滴有紫色石蕊的蒸馏水;H、足量澄清石灰水.请回答以下问题:
(1)反应开始后,若G中出现红色,H中有白色沉淀生成,判断E、F中的物质可能分别是:
稀盐酸
稀盐酸
、石灰石
石灰石
;(2)按基本反应类型写出该实验中有关反应的化学方程式:
化合反应
CO2+H2O═H2CO3
CO2+H2O═H2CO3
;分解反应
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;
| ||
置换反应
Zn+H2S04=ZnSO4+H2↑
Zn+H2S04=ZnSO4+H2↑
;复分解反应
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.通过化学学习,我们已经认识了很多化学反应.请用化学方程式回答下列问题.
(1)不用铁桶盛放硫酸铜溶液的原因
(2)用石灰乳粉刷墙壁能形成坚硬的墙面
(3)实验室用双氧水制氧气既方便快捷又环保
查看习题详情和答案>>
(1)不用铁桶盛放硫酸铜溶液的原因
Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
,该反应所属反应类型是置换反应
置换反应
.(2)用石灰乳粉刷墙壁能形成坚硬的墙面
CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
,(3)实验室用双氧水制氧气既方便快捷又环保
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
,反应所属反应类型是
| ||
分解反应
分解反应
.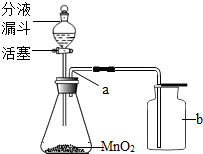 实验室常采用分解H2O2的水溶液(MnO2作催化剂)的方法制取氧气.
实验室常采用分解H2O2的水溶液(MnO2作催化剂)的方法制取氧气.(1)写出用分解H2O2的水溶液(MnO2作催化剂)制取氧气的化学方程式:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
| ||
(2)用过氧化氢分解制取氧气的装置如图所示.
①写出图中制定仪器的名称:a
导气管
导气管
,b集气瓶
集气瓶
.②用该方法收集氧气时,检验集气瓶中氧气是否集满的方法是
C
C
(填字母代号).A、把点燃的木条伸入瓶内
B、把带火星的木条伸入瓶内
C、把带火星的木条放在瓶口
③如果要得到较纯净的氧气(尽可能不含空气)最好选用
排水
排水
法收集.④如果锥形瓶中的反应很剧烈,应该采取的措施是
A
A
(填编号).A、减慢液体滴加的速度
B、换用体积较小的锥形瓶
C、加热锥形瓶.
根据要求书写化学反应方程式
(1)用石灰水作鸡蛋的保鲜剂的原理
(2)一氧化碳还原赤铁矿石(主要成分:氧化铁)
(3)过氧化氢溶液以二氧化锰为催化剂分解出氧气
(4)不能用铁制容器盛放农药波尔多液
其中,属于分解反应的是
查看习题详情和答案>>
(1)用石灰水作鸡蛋的保鲜剂的原理
CO2+Ca(OH)2═CaCO3↓+H2O
CO2+Ca(OH)2═CaCO3↓+H2O
;(2)一氧化碳还原赤铁矿石(主要成分:氧化铁)
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
;
| ||
(3)过氧化氢溶液以二氧化锰为催化剂分解出氧气
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;
| ||
(4)不能用铁制容器盛放农药波尔多液
Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
;其中,属于分解反应的是
(3)
(3)
;属于置换反应的是(4)
(4)
.完成下列变化的化学方程式,并按要求填空.
(1)二氧化碳通入水中
(2)实验室用双氧水制取氧气:
(3)铁和硫酸铜溶液反应:
(4)一氧化碳与氧化铁在高温条件下的反应:
(5)金属镁着火不能用二氧化碳扑救,因为镁可以在二氧化碳中继续燃烧生成氧化镁和碳单质:
查看习题详情和答案>>
(1)二氧化碳通入水中
CO2+H2O═H2CO3
CO2+H2O═H2CO3
;其生成物能使紫色的石蕊试液
石蕊试液
变成红色.(2)实验室用双氧水制取氧气:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;它是
| ||
放热
放热
(选填“吸热”或“放热”)分解
分解
反应.(3)铁和硫酸铜溶液反应:
Fe+CuSO4═Cu+FeSO4
Fe+CuSO4═Cu+FeSO4
;其基本反应类型是置换反应
置换反应
.(4)一氧化碳与氧化铁在高温条件下的反应:
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
(5)金属镁着火不能用二氧化碳扑救,因为镁可以在二氧化碳中继续燃烧生成氧化镁和碳单质:
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||