网址:http://m.1010jiajiao.com/timu3_id_114689[举报]
【设计实验】
用一氧化碳还原纯净的氧化铁粉末,实验装置如图.
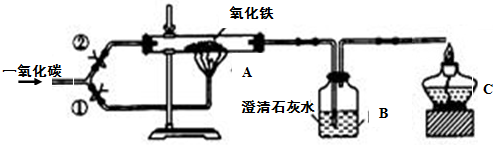
【进行实验】
(1)实验开始时,应先打开弹簧夹
(2)C处点燃酒精灯的目的是
【分析与讨论】
实验结束后,玻璃管内固体粉末由红棕色全部变成黑色.小明认为该黑色固体全部是单质铁,但小华提出了质疑,认为还可能是其它物质,如铁的常见氧化物:氧化铁、四氧化三铁、
【查阅资料】
上述氧化物中:氧化铁为红棕色,其余都为黑色;只有四氧化三铁能被磁铁吸引.
【实验与猜想】
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引.
(2)进行猜想:黑色固体粉末可能a.全部为铁 b.全部为四氧化三铁 c.
(3)该小组按上述猜想设计实验,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量m g(冷却到室温称量)
【得出结论】通过实验中获得的数据进行计算:
(1)若猜想a成立,则m=
(2)若猜想c成立,则m的取值范围为:
(10分)某兴趣小组对物质的性质和成分进行相关探究。
(1)常见金属活动性顺序如下,填写相应的元素符号:
金属活动性由强逐渐减弱
某同学用硫酸铜溶液把“铁刀变成铜刀”,其反应的化学方程式为 ,该反应的基本反应类型为 。
(2)兴趣小组同学用氧化铜与足量的炭粉利用图甲所示的装置进行实验,对生成气体的成分进行探究。
甲
[提出问题]生成的气体中是否含有一氧化碳?
[实验与讨论]
①打开K,缓缓通入干燥的氮气一段时间。
②关闭K,加热至一定温度使之反应,用气囊收集气体样品。
③除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列装置中最为合理的是 。
[实验求证]
将除尽二氧化碳后的气体样品干燥,仍然用图甲所示的装置进行实验,A中的固体应选用 ,B中溶液为澄清石灰水,若A中黑色固体出现了红色,B中澄清石灰水 ,可说明气体样品中含有一氧化碳。
[实验反思]
炭粉还原氧化铜的实验中,若生成的气体中含有一氧化碳,则反应时消耗碳、氧元素的质量比 (填“大于”、“等于”或“小于”)3∶8。
(1)常见金属活动性顺序如下,填写相应的元素符号:

金属活动性由强逐渐减弱
某同学用硫酸铜溶液把“铁刀变成铜刀”,其反应的化学方程式为 ,该反应的基本反应类型为 。
(2)兴趣小组同学用氧化铜与足量的炭粉利用图甲所示的装置进行实验,对生成气体的成分进行探究。
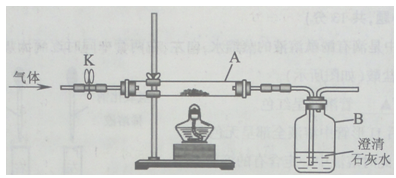
甲
[提出问题]生成的气体中是否含有一氧化碳?
[实验与讨论]
①打开K,缓缓通入干燥的氮气一段时间。
②关闭K,加热至一定温度使之反应,用气囊收集气体样品。
③除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列装置中最为合理的是 。
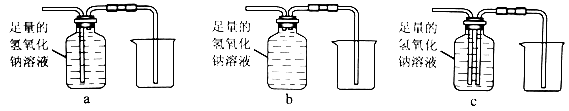
[实验求证]
将除尽二氧化碳后的气体样品干燥,仍然用图甲所示的装置进行实验,A中的固体应选用 ,B中溶液为澄清石灰水,若A中黑色固体出现了红色,B中澄清石灰水 ,可说明气体样品中含有一氧化碳。
[实验反思]
炭粉还原氧化铜的实验中,若生成的气体中含有一氧化碳,则反应时消耗碳、氧元素的质量比 (填“大于”、“等于”或“小于”)3∶8。
某学习小组对硫酸进行如下研究:
(1)已知相同温度下,硫酸的质量分数越大溶液的酸性越强。若对稀硫酸进行如下操作,溶液的pH因化学变化而升高的有 (填字母)。
A.加少量水 B.加少量铁粉 C.加少量氢氧化钾 D.加少量浓硫酸
| 时间/h | 1 | 1.5 | 4 | 8 | 12 | 24 | 48 | 60 | |
| 吸水质量/g | 硫酸甲 | 1.6 | 2.2 | 5.2 | 10.3 | 14.0 | 20.9 | 29.2 | 32.1 |
| 硫酸乙 | 1.2 | 1.5 | 3.5 | 5.9 | 8.1 | 12.9 | 19.5 | 21.0 | |
(2)向两个烧杯中分别注入硫酸甲(溶质质量分数为98%,密度为1.84g/cm3)和硫酸乙(硫酸甲与水的按体积比1︰1混和)各10mL,称量并记录不同时间(h)两种硫酸溶液吸水的质量,数据见下表:
①若量取硫酸甲时俯视读数,则所配硫酸乙的溶质质量分数将 (填填“偏大”、“偏小”或“不变”。
②由表中实验数据可知:有关硫酸吸水性的说法不正确的是 (填字母)。
A.硫酸甲和乙都有吸水性 B.只有硫酸甲有吸水性 C.硫酸甲的吸水性较硫酸乙强
(3)在高效复习课堂中,同学们利用稀释后的稀硫酸,硝酸钡、氢氧化钠、碳酸钾等物质的溶液对 “复分解反应发生的条件”进行再探究。
①将上述四种溶液两两混合,判断其两两之间能否发生反应,请写出其中符合下列条件的两个化学方程式:
一个中和反应 ;一个有沉淀生成的反应 。
②利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液。经测定,该溶液显酸性。则在该溶液中一定含有的离子是 。为了验证该溶液中可能含有的阴离子是否存在,请按如下实验进行验证。
| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
|
|
|
 一化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
一化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.【资料获悉】①铁系“脱氧剂”的作用原理是利用铁能被氧气氧化,从而达到除氧保鲜的目的.铁被氧气氧化最终产物为红棕色的Fe2O3(其他产物忽略不计).
②Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;Fe+Fe2(SO4)3=3FeSO4.
③“碱石灰的干燥管”可以用来干燥氧气、氢气等气体.
【探究目的】小组同学欲探究该“脱氧剂”是否已经失效,并测定10.00g样品各成分的质量,设计了以下探究实验.
【实验探究】(假设所有操作没有损失)
步骤1:小刚用磁铁接近样品,发现磁铁吸引了部分黑色固体.
步骤2:称取10.00g样品于一烧杯中,加足量水充分搅拌溶解后,过滤,将滤渣洗涤、干燥、称得其质量为8.32g.
步骤3:按如图装置,将得到的8.32g固体与足量稀硫酸反应,用电子秤称得反应前后总质量差为0.11g.
步骤4:将锥形瓶中反应后的液体过滤,并将滤渣洗涤、干燥后,称得其质量为1.20g.
步骤5:分析测算步骤4中所得滤液得知:滤液中溶质是硫酸和硫酸亚铁,且最后分离出16.72g硫酸亚铁.
【交流讨论】
(1)由步骤1得出的结论是
(2)步骤2目的是
(3)如果步骤4中滤渣没有经过洗涤,则称得的质量
(4)小刚认为0.11g差值即为H2的质量,并由此计算出样品中单质铁的质量为3.08g.小华提出在装置的a导管处应该再连接一个盛有碱石灰的干燥管,他这样做的理由是
(5)小华还认真分析题中所给资料,他认为用产生H2的质量计算样品中铁的质量不合理.其理由是:
【学生实验】小华将步骤3的装置进行了改进,重新称取10.00g样品进行实验,并准确测得固体与足量稀硫酸反应前后总质量差为0.1g.
(6)请根据以上数据,计算10g该样品中各成分的质量.(只写出结果)