摘要:23.(1)CaCO3==== CaO+CO2↑ CaO+H2O==== Ca(OH)2 Ca(OH)2+CO2===== CaCO3↓+H2O (2) ①100 ②140t ③3.7. 2.2
网址:http://m.1010jiajiao.com/timu3_id_111983[举报]
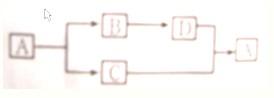 26、A、B、C、D均为初中化学中常见物质,且可发生如图所示的转化(反应条件、部分反应物和生成物已略去).其中A是相对分子质量为100的白色固体.则A为
26、A、B、C、D均为初中化学中常见物质,且可发生如图所示的转化(反应条件、部分反应物和生成物已略去).其中A是相对分子质量为100的白色固体.则A为CaCO3
B为CaO
;C为CO2
;D为Ca(OH)2
;实验室制取C的化学方程式为CaCO3+HCl═CaCl2+H2O+CO2↑
.(2014?静安区一模)采用适当的试剂,可从石灰石(主要成分是CaCO3)中获得高纯度CaCO3,其流程如下:

①流程图中进行的操作1、操作2的名称是
②写出石灰石煅烧的化学方程式
③该流程图所示物质中,溶于水放出大量热的氧化物是
④使原料中各原子的利用率尽可能达到100%是“绿色化学”的核心理念之一.上述流程中有的物质可以再利用,该流程中可循环利用的物质是
查看习题详情和答案>>

①流程图中进行的操作1、操作2的名称是
过滤
过滤
;②写出石灰石煅烧的化学方程式
CaCO3
CaO+CO2↑
| ||
CaCO3
CaO+CO2↑
,该反应的基本反应类型是
| ||
分解
分解
.③该流程图所示物质中,溶于水放出大量热的氧化物是
CaO(氧化钙)
CaO(氧化钙)
,该物质与水反应的化学方程式为CaO+H2O═Ca(OH)2
CaO+H2O═Ca(OH)2
.④使原料中各原子的利用率尽可能达到100%是“绿色化学”的核心理念之一.上述流程中有的物质可以再利用,该流程中可循环利用的物质是
CO2、H2O
CO2、H2O
(填“化学式”).湘乡韶峰水泥厂需要大量的石灰石作原料,某兴趣小组的同学为了测定某地石灰石中碳酸钙的质量分数,设计了以下两个实验方案进行测定.
方案I:①称取石灰石10g;②将石灰石高温煅烧至质量不再减轻为止(杂质不反应);③将煅烧后剩余固体放在密闭二F燥的容器中冷却至室温;④称得剩余固体质量为6.04g.
(1)步骤②中的化学方程式为CaCO3
CaO+CO2↑,这一化学反应要______(填“产生”或“吸收”)热量.
(2)步骤②中的煅烧后剩余固体为什么不能放在空气中冷却?______.
(3)煅烧时释放出CO2的质量为______.
方案Ⅱ:①称取石灰石样品10g;②加入适量的质量分数为10%的稀盐酸,使碳酸钙完全反应;③用导管将生成的二氧化碳通入澄清石灰水(过量)中;④将③中产生的沉淀过滤、洗涤、干燥、称重,得沉淀的质量为8.8g,⑤计算:
设石灰石中含CaCO3的质量为x.
∵CaCO3+2HCl=CaCl2+CO2↑+H2O CO2+Ca(OH)2=CaCO3↓+H2O
100 44 44 100
∴x=8.8g
8.8g
×100%=88%
(1)方案Ⅱ的结果(88%)与方案I的结果有差距,你认为产生这种差距的原因可能是什么?(只要求答一种原因)______.
(2)请计算步骤②中所加质量分数为10%的盐酸的质量最少要多少?
查看习题详情和答案>>
方案I:①称取石灰石10g;②将石灰石高温煅烧至质量不再减轻为止(杂质不反应);③将煅烧后剩余固体放在密闭二F燥的容器中冷却至室温;④称得剩余固体质量为6.04g.
(1)步骤②中的化学方程式为CaCO3
| ||
(2)步骤②中的煅烧后剩余固体为什么不能放在空气中冷却?______.
(3)煅烧时释放出CO2的质量为______.
方案Ⅱ:①称取石灰石样品10g;②加入适量的质量分数为10%的稀盐酸,使碳酸钙完全反应;③用导管将生成的二氧化碳通入澄清石灰水(过量)中;④将③中产生的沉淀过滤、洗涤、干燥、称重,得沉淀的质量为8.8g,⑤计算:
设石灰石中含CaCO3的质量为x.
∵CaCO3+2HCl=CaCl2+CO2↑+H2O CO2+Ca(OH)2=CaCO3↓+H2O
100 44 44 100
∴x=8.8g
| 4.4×8.8g |
| 100 |
| 4.4×8.8g |
| 100 |
| 8.8g |
| 10g |
(1)方案Ⅱ的结果(88%)与方案I的结果有差距,你认为产生这种差距的原因可能是什么?(只要求答一种原因)______.
(2)请计算步骤②中所加质量分数为10%的盐酸的质量最少要多少?
原水是取自天然水体或蓄水水体,如河流、湖泊、池塘或地下蓄水层等,用作供水水源的水,通常原水含有较多的可溶性钙镁化合物,而我国饮用水质量标准规定必须符合下表中要求:
以下是原水处理成自来水的工艺流程示意图:
(1)某自来水厂所取原水中含较多的CaCl2、MgCl2、Ca(HCO3)2 等,加入过量生石灰时一级沉降池中发生了若干化学反应,如Mg(HCO3)2+Ca(OH)2=MgCO3↓+CaCO3↓+2H2O请写出其它化学反应的化学方程式:
(2)絮凝剂在原水处理流程中的作用是:
(3)小明同学参观该自来水厂后带回家一瓶原水和一瓶自来水,匆忙间忘记贴上标签,但小明利用家中常用物质很快将两瓶水鉴别出来,他选用的物质是
查看习题详情和答案>>
| pH | Ca2+、Mg2+总数 | 细菌总数 |
| 6.5~8.5 | <2.709×1021个?L-1? | <100个?mL-1? |

(1)某自来水厂所取原水中含较多的CaCl2、MgCl2、Ca(HCO3)2 等,加入过量生石灰时一级沉降池中发生了若干化学反应,如Mg(HCO3)2+Ca(OH)2=MgCO3↓+CaCO3↓+2H2O请写出其它化学反应的化学方程式:
CaO+H2O=Ca(OH)2
CaO+H2O=Ca(OH)2
.(任写1个)(2)絮凝剂在原水处理流程中的作用是:
吸附水中悬浮杂质使之沉降
吸附水中悬浮杂质使之沉降
;通入CO2的目的是除去过量的Ca(OH)2
除去过量的Ca(OH)2
和调节pH
调节pH
.(3)小明同学参观该自来水厂后带回家一瓶原水和一瓶自来水,匆忙间忘记贴上标签,但小明利用家中常用物质很快将两瓶水鉴别出来,他选用的物质是
肥皂水
肥皂水
.(2013?高邮市二模)下列7种物质由H、C、O、S、Ca、Fe中的一种或几种元素组成.
(1)甲在乙中燃烧,火星四射,生成黑色固体.该黑色固体的化学式是
(2)甲与丙的溶液反应,可生成一种在标准状况下密度最小的气体.该反应的化学方程式是
(3)丁可中和某些工厂污水中含有的丙,反应的化学方程式
丁的溶液可用于检验无色无味的气体X,反应的化学方程式
(4)戊由3种元素组成,其相对分子质量为100,在空气中高温煅烧戊,只生成气体X和Y两种物质,其中戊、Y、X的质量比为25:14:11,该反应的化学方程式是
查看习题详情和答案>>
(1)甲在乙中燃烧,火星四射,生成黑色固体.该黑色固体的化学式是
Fe3O4
Fe3O4
.(2)甲与丙的溶液反应,可生成一种在标准状况下密度最小的气体.该反应的化学方程式是
Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
.(3)丁可中和某些工厂污水中含有的丙,反应的化学方程式
Ca(OH)2+H2SO4=CaSO4+2H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
.丁的溶液可用于检验无色无味的气体X,反应的化学方程式
Ca(OH)2+CO2=CaCO3↓+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
.(4)戊由3种元素组成,其相对分子质量为100,在空气中高温煅烧戊,只生成气体X和Y两种物质,其中戊、Y、X的质量比为25:14:11,该反应的化学方程式是
CaCO3
CaO+CO2↑
| ||
CaCO3
CaO+CO2↑
.
| ||