摘要:26. [参考答案] ------ (2)解:①根据质量守恒定律可知.生成二氧化碳的质量为: 40g + 4×2.5g - 47.8g = 2.2g ------- ② 设参加反应的CaCO3和HCl的质量分别为x和y CaCO3 + 2HCl ==== CaCl2 + H2O + CO2 ↑ 100 73 44 x y 2.2g = x = 5g = y = 3.65g ------ 则稀盐酸中溶质的质量分数为: ×100% = 9.13% ③每片中含CaCO3的质量为: =1.25g>1.24g.故钙片中碳酸钙的含量标注属实. -------- 答:①生成二氧化碳的质量为2.2g, ②稀盐酸中溶质的质量分数为9.13%, ③通过计算判断钙片中碳酸钙的含量标注属实. [思维点拨]该题目考查的是有关化学方程式的计算.以标签形式出现的题目是近几年的热点考题.考查同学们计算能力同时又考查了分析实际问题的能力.根据每片中含碳酸钙的量以及碳酸钙中该元素的含量不难计算出每片中至少含钙元素的质量为0.496g,四片药的总质量为10g加上盐酸的量总共50g,反应后成为47.8g.质量的减少是因为二氧化碳的生成.然后根据二氧化碳的量通过化学方程式计算出盐酸的质量分数.进一步判断药品含钙量是否属实. 本资料由 提供!
网址:http://m.1010jiajiao.com/timu3_id_10843[举报]
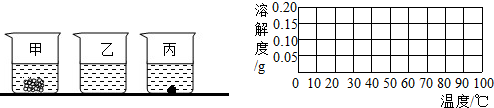
下表为氯化钠、硝酸钾和氢氧化钙在不同温度下的溶解度.
(1)20℃时分别往盛有100g水的烧杯中加入上述三种物质各35g,充分溶解后如右图所示,则乙烧杯中的溶质是 .
(2)要使丙烧杯中的固体完全溶解,可采取的一种措施是 .
(3)请根据上表数据在右图表格中画出氢氧化钙的溶解度曲线.
(4)熟石灰常用作中和硫酸厂排放的少量硫酸现有100t含硫酸0.49%的废水,该废水含有硫酸的质量 ,完全处理这些废水需要氢氧化钙的质量是 .
 查看习题详情和答案>>
查看习题详情和答案>>
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶 解/g 度 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
| Ca(OH)2 | 0.187 | 0.178 | 0.165 | 0.153 | 0.141 | 0.129 | 0.116 | |
(2)要使丙烧杯中的固体完全溶解,可采取的一种措施是
(3)请根据上表数据在右图表格中画出氢氧化钙的溶解度曲线.
(4)熟石灰常用作中和硫酸厂排放的少量硫酸现有100t含硫酸0.49%的废水,该废水含有硫酸的质量
 查看习题详情和答案>>
查看习题详情和答案>>
 淡水资源紧缺的原因之一是人类的生产、生活造成了水的污染.某城镇生产、生活区的分布如下图所示.河流中A、B、C三处某次水样抽测结果如表所示.
淡水资源紧缺的原因之一是人类的生产、生活造成了水的污染.某城镇生产、生活区的分布如下图所示.河流中A、B、C三处某次水样抽测结果如表所示.| 地点 项目 |
A | B | C |
| pH | 6 | 4 | 5 |
| 1L水中 溶解的氧气 |
0.011g | 0.007g | 0.003g |
(1)测定水样PH的操作
在玻璃片上放一小片pH试纸,然后将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH
在玻璃片上放一小片pH试纸,然后将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH
.(2)为了减少硫酸厂废水对河水的污染,要选用一种廉价的物质进行处理,你选择的物质是
Ca(OH)2
Ca(OH)2
(填化学式).(3)C处水草疯长,鱼虾几乎绝迹,主要原因是河水中
N
N
、P两种元素含量过高.(4)你认为在A、B、C三处中,最适合作自来水厂取水点的是
A
A
.(5)硫酸厂排放的污水中主要成分是硫酸,提取未经处理的污水水样l000g,加入含4gNaOH的溶液恰好完全反应(废水中其它成分不与氢氧化钠反应),反应的化学方程式是
2NaOH+H2SO4═Na2SO4+2H2O
2NaOH+H2SO4═Na2SO4+2H2O
,该废水中硫酸的质量为4.9
4.9
克,废水中硫酸的质量分数为0.49%
0.49%
(本空结果精确到0.01%).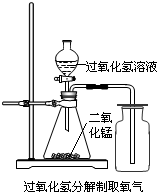 (2004?北碚区)实验室中,常采用分解过氧化氢溶液(二氧化锰作催化剂)或加热高锰酸钾的方法制取氧气.
(2004?北碚区)实验室中,常采用分解过氧化氢溶液(二氧化锰作催化剂)或加热高锰酸钾的方法制取氧气.(1)写出用上述两种方法分别制取氧气的化学反应方程式:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
、
| ||
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
.
| ||
(2)用过氧化氢分解制取氧气的装置如图所示:
图中收集氧气的方法叫做
向上排空气法
向上排空气法
.可用此方法收集氧气的原因是O2的密度比空气密度略大
O2的密度比空气密度略大
(3)用该方法收集氧气时,检验集气瓶中氧气是否集满的方法是
C
C
.A.把点燃的木条伸入瓶内
B.把带火星的木条伸人瓶内
C.把带火星的木条放在瓶口
(4)如果锥形瓶中的反应很剧烈,应该采取的安全措施是
①
①
(填编号).①减慢液体滴加的速度 ②换用体积较小的锥形瓶 ③加热锥形瓶
(5)请计算,制取3.2g氧气,理论上需高锰酸钾的质量为
31.6
31.6
g;需质量分数为30%过氧化氢溶液的质量为22.7
22.7
g.(6)某化学试剂公司报价:高锰酸钾30.50元/kg,30%过氧化氢溶液21.70元/kg.请从实验操作和生产成本两方面考虑,用
分解过氧化氢
分解过氧化氢
方法制取氧气更好(二氧化锰价格低、耗量少,忽略不计).这种方法的主要优点是①实验室用H2O2制取02不需加热,②制取相同质量(3.2g)O2时购买H2O2(约0.49元)比KMnO4(约0.96元)价格低
①实验室用H2O2制取02不需加热,②制取相同质量(3.2g)O2时购买H2O2(约0.49元)比KMnO4(约0.96元)价格低
.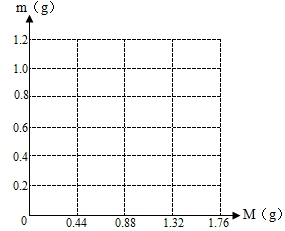 将KCl和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的0.44g.
将KCl和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的0.44g.(1)原混合物中Ca(OH)2的质量为
0.74
0.74
g;(2)写出溶液中生成沉淀的质量m(g)与通入CO2的质量M(g)之间的函数表达式
①
0≤M<0.44,m=100M/44
0≤M<0.44,m=100M/44
;②0.44≤M≤0.88 m=1-
或
或2-(100M/44)或其它合理答案
| 100(M-0.44) |
| 44 |
| 88-100M |
| 44 |
0.44≤M≤0.88 m=1-
或
或2-(100M/44)或其它合理答案
;| 100(M-0.44) |
| 44 |
| 88-100M |
| 44 |
(3)在图示坐标系上,画出生成沉淀的质量m(g)与通入CO2的质量M(g)的关系曲线.