摘要: [参考答案]氯化钠和砝码位置放反了.造成称量不准(或量筒中的水没有沿烧杯壁倒入.造成液滴飞溅)12.偏小 ③ [思维点拨]该题目考查的是溶液的配制.溶液的配制需要的玻璃仪器有:广口瓶烧杯.玻璃棒.量筒.以及滴管.用天平称量药品时.应是“左物右码 .量筒中的水应沿烧杯壁慢慢倾倒.以防止液体飞溅而使溶剂量减少.所称取得12g氯化钠中如有杂质.则说明氯化钠的量就不足12g.所以会使得溶质质量分数偏小.根据计算水的用量为:88g水.即:88mL水.所以要用100mL的量筒.
网址:http://m.1010jiajiao.com/timu3_id_10790[举报]
(2013?宜昌)有一包白色固体样品,可能是碳酸钠、硫酸钡、氢氧化钠、氯化钡中的一种或几种.为探究其成分,小燕老师取用一定量样品,加水溶解,过滤得到白色沉淀甲和无色滤液乙.
写出上述操作中可能发生反应的化学方程式:
【探究活动一】奋进小组探究白色沉淀甲的成分.
【探究活动二】智慧小组探究白色固体样品中可能含有
【反思】实验Ⅱ中步骤①加入过量试剂的目的
【结论】通过两个小组的共同探究,得出了原白色固体样品中含有的成分.
查看习题详情和答案>>
写出上述操作中可能发生反应的化学方程式:
Na2CO3+Ba Cl2═Ba CO3↓+2NaCl
Na2CO3+Ba Cl2═Ba CO3↓+2NaCl
.过滤时用到玻璃棒,玻璃棒的作用是引流
引流
.【探究活动一】奋进小组探究白色沉淀甲的成分.
| 实验操作 | 实验现象 | 结论 |
| 取白色沉淀甲,滴加足量的稀硝酸 | 沉淀部分消失 | 白色沉淀甲中一定含有 硫酸钡、碳酸钡 硫酸钡、碳酸钡 |
氢氧化钠
氢氧化钠
,设计了如下实验:| 实验操作 | 实验现象 | 结论 | |
| 实验Ⅰ | 取无色滤液乙,加入碳酸钠溶液 | 无明显现象 | 无色滤液乙中一定不含 氯化钡 氯化钡 |
| 实验Ⅱ | 步骤①:取适量白色滤液乙,加入过量的 氯化钙 氯化钙 溶液,过滤 |
生成白色沉淀 | 原白色固体样品中一定存在该物质 |
| 步骤②:取步骤①中的滤液,滴加 酚酞试液 酚酞试液 溶液 |
酚酞试液变红色 酚酞试液变红色 | ||
使碳酸钠完全反应
使碳酸钠完全反应
.【结论】通过两个小组的共同探究,得出了原白色固体样品中含有的成分.
 小明同学参加学校的化学实验技能竞赛,他抽到的试题内容如下:有一包白色固体可能含有BaCl2、KNO3、CuSO4、Na2CO3中的一种或几种,请设计合理的实验方案,通过实验得出有关结论.经过一番思考,小明决定通过如下步骤进行实验,以得出相关结论.
小明同学参加学校的化学实验技能竞赛,他抽到的试题内容如下:有一包白色固体可能含有BaCl2、KNO3、CuSO4、Na2CO3中的一种或几种,请设计合理的实验方案,通过实验得出有关结论.经过一番思考,小明决定通过如下步骤进行实验,以得出相关结论.(1)他决定先用药匙取少量白色固体放入烧杯中,加少量水使之充分溶解.他选用的仪器除药匙、烧杯外,还用到的仪器是
玻璃棒
玻璃棒
.溶解过程中,他观察到有白色沉淀生成.(2)过滤后,小明观察到滤液是无色的,于是他得出了第一个结论:这包白色固体中肯定没有
硫酸铜
硫酸铜
,因为如果此物质存在,滤液可能呈蓝
蓝
色.继而他推断这包白色固体中肯定存在氯化钡
氯化钡
和碳酸钠
碳酸钠
,因为只有它们存在,才会产生白色沉淀,反应的化学方程式是Na2CO3+BaCl2=2NaCl+BaCO3↓
Na2CO3+BaCl2=2NaCl+BaCO3↓
.(3)根据产生白色沉淀的化学方程式,他认为滤液中一定含有的溶质是
氯化钠
氯化钠
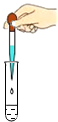
.所以,他取少量滤液于试管中,并按如图所示操作滴加硝酸银溶液.反应的化学方程式是NaCl+AgNO3=NaNO3+AgCl↓
NaCl+AgNO3=NaNO3+AgCl↓
.此操作中出现的错误是没有将滴管悬空在试管口正上方
没有将滴管悬空在试管口正上方
.某化学兴趣小组设计出下列粗盐分离提纯的实验方案,请你一起来完成下列问题.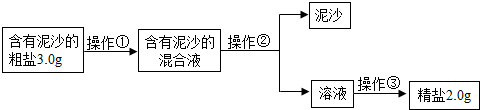
(1)操作①的名称是
(2)实施操作③时需要用到玻璃棒,其作用是
(3)计算精盐的产率是
(4)若精盐的产率偏低,则可能的原因是
A.过滤时滤纸有破损
B.蒸发时液体有溅出
C.溶解含有泥沙的粗盐时,加入的水量过多
D.转移精盐时,蒸发皿中残留较多固体
(5)精盐中还含有CaCl2、Na2SO4等杂质,为了除去可溶性杂质,依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量的盐酸.实验中加入过量的BaCl2溶液是为了除去
查看习题详情和答案>>

(1)操作①的名称是
溶解
溶解
(2)实施操作③时需要用到玻璃棒,其作用是
搅拌,防止液滴飞溅
搅拌,防止液滴飞溅
(3)计算精盐的产率是
66.7%
66.7%
(计算结果保留一位小数);(4)若精盐的产率偏低,则可能的原因是
BD
BD
A.过滤时滤纸有破损
B.蒸发时液体有溅出
C.溶解含有泥沙的粗盐时,加入的水量过多
D.转移精盐时,蒸发皿中残留较多固体
(5)精盐中还含有CaCl2、Na2SO4等杂质,为了除去可溶性杂质,依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量的盐酸.实验中加入过量的BaCl2溶液是为了除去
硫酸钠
硫酸钠
,加入过量的Na2CO3溶液的目的是除去氯化钙和过量的氯化钡
除去氯化钙和过量的氯化钡
. (2009?连云港) NaNO2(亚硝酸钠)、NaCl和物质M (不含结晶水)的溶解度曲线如图所示,请根据图象和有关信息回答下列问题:
(2009?连云港) NaNO2(亚硝酸钠)、NaCl和物质M (不含结晶水)的溶解度曲线如图所示,请根据图象和有关信息回答下列问题:(1)t2℃时,NaNO2、NaCl和M的溶解度由大到小的顺序是
NaNO2>NaCl>M
NaNO2>NaCl>M
.(2)如图所示,当往试管中加入5mL稀盐酸时,试管内立刻产生大量气泡,同时放热使烧杯中饱和溶液变浑浊(不考虑水分蒸发).请判断:该饱和溶液中的溶质是NaNO2、NaCl和M中的
M
M
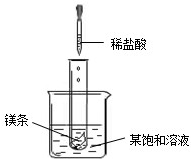
(3)分别将NaNO2、NaCl和M的饱和溶液从t2℃降温到t1℃时,三种溶液中溶质的质量分由大到小的顺序是
NaNO2>NaCl>M
NaNO2>NaCl>M
.(4)NaNO2有毒,其外观和咸味与食盐很相似,因此要防止因误食NaNO2而发生中毒事故.为了区别NaNO2、NaCl固体,某化学兴趣小组同学查阅资料获得如下信息:NaNO2的水溶液呈碱性,NaCl的水溶液呈中性;NaNO2熔点为271℃,NaCl熔点为801℃.
①小明同学设计的鉴别实验方案如下:
20℃时分别取NaNO2、NaCl各5.0g于两只小烧杯中,分别加入10mL水(水的密度近似看作1g/cm3),用玻璃棒充分搅拌后观察.你认为此方案是否可行
可行
可行
(填“可行”或“不可行”).②该小组其他同学又设计出与小明不同的实验方案,并获得成功.你认为该方案可能是
分别取少量的NaNO2、NaCl固体于两支试管中,用酒精灯加热,熔化者为NaNO2,不熔者为NaCl(或分别取少量样品于试管中,加水溶解,滴加无色酚酞试液,变红者为NaNO2,不变者为NaCl)(或其他合理答案)
分别取少量的NaNO2、NaCl固体于两支试管中,用酒精灯加热,熔化者为NaNO2,不熔者为NaCl(或分别取少量样品于试管中,加水溶解,滴加无色酚酞试液,变红者为NaNO2,不变者为NaCl)(或其他合理答案)
(只填写一种方案并简单叙述).(2010?清远)人类生活离不开水,长达多半年之久的西南干旱牵动着每个中国人的心.为了了解我市水资源,某中学研究性学习小组对北江水质的状况进行相关的调查研究.
(1)取水样,静置后过滤.过滤操作中需要用到的玻璃仪器有漏斗、烧杯和
(2)若要检验北江水属于硬水还是软水,可用的物质是
(3)若要测定北江水的酸碱性强弱程度,可选择
A.紫色石蕊试液 B.无色酚酞试液 C.pH试纸
(4)工作人员每天撑着小船在江中打捞垃圾,其中塑料制品、易拉罐应投入下列
A.不可回收垃圾箱 B.可回收垃圾箱
(5)你认为下列行为不会造成北江水质下降的是
A.在江边种植花草树木
B.居民将生活污水直接排入江中
C.某些游客将垃圾随手丢入江中.
查看习题详情和答案>>
(1)取水样,静置后过滤.过滤操作中需要用到的玻璃仪器有漏斗、烧杯和
玻璃棒
玻璃棒
(2)若要检验北江水属于硬水还是软水,可用的物质是
肥皂水(或其他合理答案)
肥皂水(或其他合理答案)
.(3)若要测定北江水的酸碱性强弱程度,可选择
C
C
.A.紫色石蕊试液 B.无色酚酞试液 C.pH试纸
(4)工作人员每天撑着小船在江中打捞垃圾,其中塑料制品、易拉罐应投入下列
B
B
(填字母)垃圾桶内.A.不可回收垃圾箱 B.可回收垃圾箱
(5)你认为下列行为不会造成北江水质下降的是
A
A
(填字母).A.在江边种植花草树木
B.居民将生活污水直接排入江中
C.某些游客将垃圾随手丢入江中.
