题目内容
(2013?宜昌)有一包白色固体样品,可能是碳酸钠、硫酸钡、氢氧化钠、氯化钡中的一种或几种.为探究其成分,小燕老师取用一定量样品,加水溶解,过滤得到白色沉淀甲和无色滤液乙.
写出上述操作中可能发生反应的化学方程式:
【探究活动一】奋进小组探究白色沉淀甲的成分.
【探究活动二】智慧小组探究白色固体样品中可能含有
【反思】实验Ⅱ中步骤①加入过量试剂的目的
【结论】通过两个小组的共同探究,得出了原白色固体样品中含有的成分.
写出上述操作中可能发生反应的化学方程式:
Na2CO3+Ba Cl2═Ba CO3↓+2NaCl
Na2CO3+Ba Cl2═Ba CO3↓+2NaCl
.过滤时用到玻璃棒,玻璃棒的作用是引流
引流
.【探究活动一】奋进小组探究白色沉淀甲的成分.
| 实验操作 | 实验现象 | 结论 |
| 取白色沉淀甲,滴加足量的稀硝酸 | 沉淀部分消失 | 白色沉淀甲中一定含有 硫酸钡、碳酸钡 硫酸钡、碳酸钡 |
氢氧化钠
氢氧化钠
,设计了如下实验:| 实验操作 | 实验现象 | 结论 | |
| 实验Ⅰ | 取无色滤液乙,加入碳酸钠溶液 | 无明显现象 | 无色滤液乙中一定不含 氯化钡 氯化钡 |
| 实验Ⅱ | 步骤①:取适量白色滤液乙,加入过量的 氯化钙 氯化钙 溶液,过滤 |
生成白色沉淀 | 原白色固体样品中一定存在该物质 |
| 步骤②:取步骤①中的滤液,滴加 酚酞试液 酚酞试液 溶液 |
酚酞试液变红色 酚酞试液变红色 | ||
使碳酸钠完全反应
使碳酸钠完全反应
.【结论】通过两个小组的共同探究,得出了原白色固体样品中含有的成分.
分析:硫酸钡是一种不溶于水的白色沉淀,碳酸钠和氯化钡反应能够生成白色沉淀碳酸钡;硫酸钡一般不溶于水、酸、碱,碳酸钡不溶于水,溶于酸;
玻璃棒的作用有:引流、搅拌、转移物质等;
根据实验现象可以判断物质的存在情况.
玻璃棒的作用有:引流、搅拌、转移物质等;
根据实验现象可以判断物质的存在情况.
解答:解:碳酸钠和氯化钡能够反应生成碳酸钡和氯化钠,上述操作中可能发生反应的是碳酸钠和氯化钡,反应的化学方程式为:Na2CO3+BaCl2═BaCO3↓+2NaCl,过滤时用到玻璃棒,玻璃棒的作用是引流.故填:Na2CO3+BaCl2═BaCO3↓+2NaCl;引流.
【探究活动一】
滴加足量的稀硝酸时,沉淀部分消失,说明沉淀中既有原来的硫酸钡,又有反应生成的碳酸钡,原来的硫酸钡不能溶解,而生成的碳酸钡能和稀硝酸反应,溶解.
故填:硫酸钡、碳酸钡.
【探究活动二】
由分析可知,样品中含有碳酸钠、硫酸钡和氯化钡,那么样品中是否含有氢氧化钠呢?智慧小组探究白色固体样品中可能含有氢氧化钠.
故填:氢氧化钠.
取无色滤液乙,加入碳酸钠溶液时无明显现象,说明样品中的氯化钡已经和碳酸钠完全反应,滤液中一定不含有氯化钡.
故填:氯化钡.
取适量滤液乙,加入过量的氯化钙溶液,有白色沉淀生成,说明滤液中含有碳酸钠,加入过量的氯化钙可以把碳酸钠除去.
故填:氯化钙.
步骤①中的滤液中,氯化钠、氯化钙显中性,不能使酚酞试液变色,如果样品中含有氢氧化钠时,步骤①中的滤液显碱性,如果不含有氢氧化钠时,步骤①中的滤液显中性,可以通过滴加酚酞试液检验,结论中原白色固体样品中一定存在该物质,那么加入酚酞试液时,酚酞试液变红色.
故填:酚酞试液;酚酞试液变红色.
实验Ⅱ中步骤①加入过量试剂的目的是使碳酸钠完全反应,排除对检验氢氧化钠的干扰.
故填:使碳酸钠完全反应.
【探究活动一】
滴加足量的稀硝酸时,沉淀部分消失,说明沉淀中既有原来的硫酸钡,又有反应生成的碳酸钡,原来的硫酸钡不能溶解,而生成的碳酸钡能和稀硝酸反应,溶解.
故填:硫酸钡、碳酸钡.
【探究活动二】
由分析可知,样品中含有碳酸钠、硫酸钡和氯化钡,那么样品中是否含有氢氧化钠呢?智慧小组探究白色固体样品中可能含有氢氧化钠.
故填:氢氧化钠.
取无色滤液乙,加入碳酸钠溶液时无明显现象,说明样品中的氯化钡已经和碳酸钠完全反应,滤液中一定不含有氯化钡.
故填:氯化钡.
取适量滤液乙,加入过量的氯化钙溶液,有白色沉淀生成,说明滤液中含有碳酸钠,加入过量的氯化钙可以把碳酸钠除去.
故填:氯化钙.
步骤①中的滤液中,氯化钠、氯化钙显中性,不能使酚酞试液变色,如果样品中含有氢氧化钠时,步骤①中的滤液显碱性,如果不含有氢氧化钠时,步骤①中的滤液显中性,可以通过滴加酚酞试液检验,结论中原白色固体样品中一定存在该物质,那么加入酚酞试液时,酚酞试液变红色.
故填:酚酞试液;酚酞试液变红色.
实验Ⅱ中步骤①加入过量试剂的目的是使碳酸钠完全反应,排除对检验氢氧化钠的干扰.
故填:使碳酸钠完全反应.
点评:根据实验现象进行判断时,要对硫酸钡和碳酸钡的溶解性有一个全面的理解,硫酸钡一般不溶于水、酸和碱,而碳酸钡属于碳酸盐,溶于酸.

练习册系列答案
相关题目
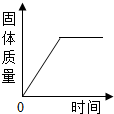 (2013?宜昌)在下列实验中,试管内固体质量随时间变化关系正确的是( )
(2013?宜昌)在下列实验中,试管内固体质量随时间变化关系正确的是( )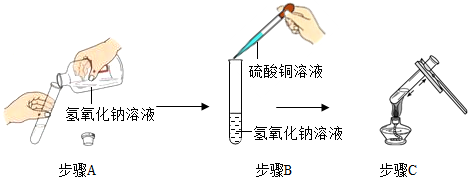
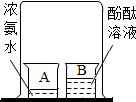 (2013?宜昌)回答下列问题:
(2013?宜昌)回答下列问题: