网址:http://m.1010jiajiao.com/timu3_id_107241[举报]
【查阅资料提出问题】这种淡黄色粉末是什么?有什么性质和用途?

①硫是淡黄色粉末,不溶于水;②过氧化钠(Na2O2)是淡黄色粉末,在常温下能与水反应生成氢氧化钠(NaOH)和一种气体,氢氧化钠可溶于水.
【猜想与探究】
猜想(1):淡黄色粉末可能是:a.硫;b.过氧化钠;c.硫和过氧化钠的混合物.
探究:过氧化钠与水反应的生成物的成分.
猜想(2):过氧化钠与水反应生成的气体可能是a氢气;b
【实验与结论】
| 实验操作 | 实验现象 | 实验结论 | |
| 猜想(1) | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水 | 黄色粉末全部消失 黄色粉末全部消失 |
猜想a、c不成立,猜想b成立. |
| 猜想(2) | 把水加入放有过氧化钠的试管中,伸入带火星的木条 把水加入放有过氧化钠的试管中,伸入带火星的木条 |
木条复燃 木条复燃 |
生成物中的气体是 氧气 氧气 |
| 实验操作 | 实验现象 | 实验结论 |
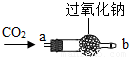
| ①将CO2从a口处通入装置内,再把带火星的木条放在装置b口处 | 木条复燃 | CO2在常温下能与过氧化钠反应,该反应的化学方程式为: 2Na2O2+2CO2═2Na2CO3+O2 2Na2O2+2CO2═2Na2CO3+O2 |
| ②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的氢气通入澄清石灰水中 | 有气泡产生 石灰水变浑浊 |
 学生对实验室内的一包淡黄色粉末发生浓厚兴趣,并在老师的指导下进行探究活动.
学生对实验室内的一包淡黄色粉末发生浓厚兴趣,并在老师的指导下进行探究活动.
【查阅资料提出问题】这种淡黄色粉末是什么?有什么性质和用途?
①硫是淡黄色粉末,不溶于水;②过氧化钠(Na2O2)是淡黄色粉末,在常温下能与水反应生成氢氧化钠(NaOH)和一种气体,氢氧化钠可溶于水.
【猜想与探究】
猜想(1):淡黄色粉末可能是:a.硫;b.过氧化钠;c.硫和过氧化钠的混合物.
探究:过氧化钠与水反应的生成物的成分.
猜想(2):过氧化钠与水反应生成的气体可能是a氢气;b________;小明认为该气体不可能是氢气,理由是________
【实验与结论】
| 实验操作 | 实验现象 | 实验结论 | |
| 猜想(1) | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水 | ________ | 猜想a、c不成立,猜想b成立. |
| 猜想(2) | ________ | ________ | 生成物中的气体是________ |
| 实验操作 | 实验现象 | 实验结论 |
| ①将CO2从a口处通入装置内,再把带火星的木条放在装置b口处 | 木条复燃 | CO2在常温下能与过氧化钠反应,该反应的化学方程式为:________ |
| ②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的氢气通入澄清石灰水中 | 有气泡产生 石灰水变浑浊 |
【查阅资料提出问题】这种淡黄色粉末是什么?有什么性质和用途?
①硫是淡黄色粉末,不溶于水;②过氧化钠(Na2O2)是淡黄色粉末,在常温下能与水反应生成氢氧化钠(NaOH)和一种气体,氢氧化钠可溶于水.
【猜想与探究】
猜想(1):淡黄色粉末可能是:a.硫;b.过氧化钠;c.硫和过氧化钠的混合物.
探究:过氧化钠与水反应的生成物的成分.
猜想(2):过氧化钠与水反应生成的气体可能是a氢气;b______;小明认为该气体不可能是氢气,理由是______
【实验与结论】
| 实验操作 | 实验现象 | 实验结论 | |
| 猜想(1) | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水 | ______ | 猜想a、c不成立,猜想b成立. |
| 猜想(2) | ______ | ______ | 生成物中的气体是______ |
| 实验操作 | 实验现象 | 实验结论 |
| ①将CO2从a口处通入装置内,再把带火星的木条放在装置b口处 | 木条复燃 | CO2在常温下能与过氧化钠反应,该反应的化学方程式为:______ |
| ②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的氢气通入澄清石灰水中 | 有气泡产生 石灰水变浑浊 |
 查看习题详情和答案>>
查看习题详情和答案>>
过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,同学们将包有Na2O2固体的棉花放入了如右图所示的装置中,发现高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时也惊奇地发现棉花燃烧了起来。
(1)实验过程中蜡烛由下往上依次熄灭,说明二氧化碳
具有 的性质。
(2)棉花为什么会燃烧呢?同学们认为棉花要燃烧,除了满足棉花是可燃物之外,还需
满足 、  。
。
【提出问题】上述实验中是如何给棉花提供燃烧条件的?
【查阅资料】1.在常温下Na2O2与CO2、H2O均能发生化学反应。
2.无水硫酸铜为白色固体,吸水后变为蓝色。
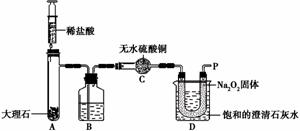
【实验设计】经过讨论,同学们设计用下图所示装置进行实验探究。
 | |||
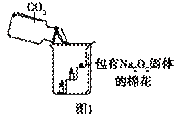 | |||
【实验步骤】①检查整套装置的气密性; ②把相关的试剂放入对应的仪器内;
③用力推动针筒的活塞,把稀盐酸注入试管内;
④一段时间后,在P处放 置一根带火星的木条,观察现
置一根带火星的木条,观察现 象。
象。
注意:大理石与稀盐酸制取的CO2还会含有一定量的水蒸气,但整个实验过程中不考虑稀盐酸的挥发和空气对实验的影响。
【实验现象】
①带火星的木条复燃; ②无水硫酸铜没有变蓝色; ③饱和的澄清石灰水变浑浊。
【实验分析】①B装置内盛放的试剂是 ;②D装置烧杯内澄清石灰水变浑浊的原因可能是 ,也可能是空气中的CO2与澄清石灰水反应生成了难溶物使澄清石灰水变混浊。
【实 验结论】
验结论】 ①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件。
①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件。
②Na2O2和CO2反应过程中伴随能量变化,使图1中的棉花满足了燃烧的另一个条件。
【拓展提高】①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,学生甲认为生成的固体是NaOH,学生乙认为是Na2CO3,同学们经思考后认为甲同学的猜想是错误的,理由是 。
②写出Na2O2和CO2反应的化学方程式  。
。
【定量探究】有一包久置的过氧化钠粉末,现已证明因其保存不当导致完全变质成为NaOH和Na2CO3的混合物,同学们称取了13.25g样品,加入足量稀盐酸,并将产生的气体通入足量的澄清石灰水中,得到白色沉淀,经过滤、洗涤、烘干后称得其质量为10g,试计算:样品中Na2CO3的质量分数。
查看习题详情和答案>>