摘要:在核电荷数小于18的原子中.X原子核内有a个质子.它的阳离子 与Y元素的阴离子 的电子层结构相同.则元素Y的原子的核电荷数是 .
网址:http://m.1010jiajiao.com/timu3_id_104920[举报]
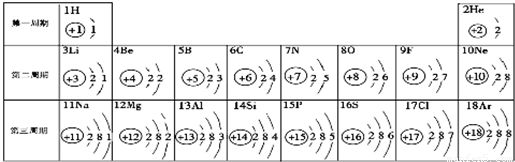
元素周期表是学习化学的重要工具.如图是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:

(1)生物体中含量最多的元素名称是
(2)某原子结构示意图为 ,其中X值为
,其中X值为
(3)原子序数为12和17的原子不属于同一种元素,原因是
A.质子数 B.相对原子质量 C.中子数 D.电子数
(4)研究表明:第二周期3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.我分析第三周期11~17号元素原子半径变化规律是
查看习题详情和答案>>

(1)生物体中含量最多的元素名称是
氧
氧
,该元素属于非金属
非金属
元素(填“金属”或“非金属”),它在化学反应中容易得
得
(填“得”或“失”)电子.(2)某原子结构示意图为
 ,其中X值为
,其中X值为20
20
,它位于元素周期表里第四
四
周期,该粒子的最外层电子数为2
2
.(3)原子序数为12和17的原子不属于同一种元素,原因是
A
A
不同(填字母).A.质子数 B.相对原子质量 C.中子数 D.电子数
(4)研究表明:第二周期3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.我分析第三周期11~17号元素原子半径变化规律是
原子半径逐渐减小
原子半径逐渐减小
.元素周期表是学习化学的重要工具.如图是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:

(1)生物体中含量最多的元素名称是______,该元素属于______元素(填“金属”或“非金属”),它在化学反应中容易______(填“得”或“失”)电子.
(2)某原子结构示意图为 ,其中X值为______,它位于元素周期表里第______周期,该粒子的最外层电子数为______.
,其中X值为______,它位于元素周期表里第______周期,该粒子的最外层电子数为______.
(3)原子序数为12和17的原子不属于同一种元素,原因是______ 不同(填字母).
A.质子数 B.相对原子质量 C.中子数 D.电子数
(4)研究表明:第二周期3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.我分析第三周期11~17号元素原子半径变化规律是______.
查看习题详情和答案>>
元素周期表是学习化学的重要工具.如图是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
(1)生物体中含量最多的元素名称是______,该元素属于______元素(填“金属”或“非金属”),它在化学反应中容易______(填“得”或“失”)电子.
(2)某原子结构示意图为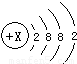 ,其中X值为______,它位于元素周期表里第______周期,该粒子的最外层电子数为______.
,其中X值为______,它位于元素周期表里第______周期,该粒子的最外层电子数为______.
(3)原子序数为12和17的原子不属于同一种元素,原因是______ 不同(填字母).
A.质子数 B.相对原子质量 C.中子数 D.电子数
(4)研究表明:第二周期3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.我分析第三周期11~17号元素原子半径变化规律是______.
查看习题详情和答案>>

(1)生物体中含量最多的元素名称是______,该元素属于______元素(填“金属”或“非金属”),它在化学反应中容易______(填“得”或“失”)电子.
(2)某原子结构示意图为
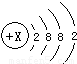 ,其中X值为______,它位于元素周期表里第______周期,该粒子的最外层电子数为______.
,其中X值为______,它位于元素周期表里第______周期,该粒子的最外层电子数为______.(3)原子序数为12和17的原子不属于同一种元素,原因是______ 不同(填字母).
A.质子数 B.相对原子质量 C.中子数 D.电子数
(4)研究表明:第二周期3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.我分析第三周期11~17号元素原子半径变化规律是______.
查看习题详情和答案>>
人类对原子结构的认识永无止境.

(1)道尔顿认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今这些观点均
(2)下图①、②是氧元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图.

①、氧元素的相对原子质量为
②、D中的X=
③、以上A、B、C、D粒子结构示意图中,表示稀有气体元素的原子的是
④、B和
⑤、A、B、C、D粒子中化学性质相似的是
(3)元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:

①、第16号元素属于
中容易
②、元素的化学性质与原子结构中的
③、在同一族中,各元素的原子结构呈现的规律有
④、研究表明:第二周期从3--9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.我分析第三周期从11--17号元素原子半径变化规律是
查看习题详情和答案>>

(1)道尔顿认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今这些观点均
错误
错误
(填“正确”或“错误”),卢瑟福进行α粒子散射实验后,认为原子是“行星模型”,即原子是由带正
正
电荷的原子核和核外电子构成.(2)下图①、②是氧元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图.

①、氧元素的相对原子质量为
16.00
16.00
,钙元素的原子序数(即质子数)为20
20
;②、D中的X=
11
11
;③、以上A、B、C、D粒子结构示意图中,表示稀有气体元素的原子的是
A
A
;④、B和
C
C
属于同种元素的粒子(用“A”、“C”、“D”填空).⑤、A、B、C、D粒子中化学性质相似的是
A
A
和C
C
(填序号);(3)元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:

①、第16号元素属于
非金属
非金属
元素(填“金属”或“非金属”),它在化学反应中容易
得
得
(填“得”或“失”)电子;②、元素的化学性质与原子结构中的
最外层电子
最外层电子
数关系密切;③、在同一族中,各元素的原子结构呈现的规律有
从左到右各原子的质子数依次递增
从左到右各原子的质子数依次递增
(任写一点);④、研究表明:第二周期从3--9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.我分析第三周期从11--17号元素原子半径变化规律是
原子半径逐渐减小
原子半径逐渐减小
.(2006?绵阳)(1)某元素的原子结构示意图为 ,它的原子核内有
,它的原子核内有
(2)夏天,打开汽水瓶盖时,汽水会自动喷出来,如果打开冰冻汽水的瓶盖,则只有少许气泡冒出.上述事实表明,气体的溶解度随外界条件的变化关系是
(3)孔雀石能发生如下图所示变化:
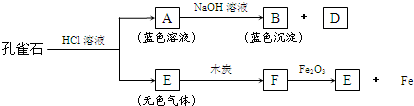
①推断A、B、D、E是何种物质,写出它们的化学式:
A
②从图中转化关系可以初步判断,孔雀石中含有的元素是
③F跟Fe2O3反应的化学方程式是
(4)人体内的钙99% 存在于骨骼和牙齿中,主要以羟基磷酸钙晶体的形式存在.羟基磷酸钙的化学式为Ca10(PO4)6(OH)x,其中x=
查看习题详情和答案>>
 ,它的原子核内有
,它的原子核内有16
16
个质子,它与核电荷数为11的元素形成的化合物化学式为Na2S
Na2S
,它与地壳中含量最多的元素形成的一种大气污染物化学式为SO2
SO2
.(2)夏天,打开汽水瓶盖时,汽水会自动喷出来,如果打开冰冻汽水的瓶盖,则只有少许气泡冒出.上述事实表明,气体的溶解度随外界条件的变化关系是
气体溶解度随压强减小而减小
气体溶解度随压强减小而减小
,随温度降低而增大
随温度降低而增大
.(3)孔雀石能发生如下图所示变化:

①推断A、B、D、E是何种物质,写出它们的化学式:
A
CuCl2
CuCl2
,BCu(OH)2
Cu(OH)2
,DNaCl
NaCl
,ECO2
CO2
.②从图中转化关系可以初步判断,孔雀石中含有的元素是
Cu和C
Cu和C
.③F跟Fe2O3反应的化学方程式是
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
,该反应中具有还原性的物质是
| ||
CO
CO
.(4)人体内的钙99% 存在于骨骼和牙齿中,主要以羟基磷酸钙晶体的形式存在.羟基磷酸钙的化学式为Ca10(PO4)6(OH)x,其中x=
2
2
.乳酸钙是一种常用的人体补钙剂,它的化学式为 (C3H5O3)2Ca,则乳酸钙中C、H、O三种元素的质量比为36:5:48
36:5:48
.钙元素的质量分数为18.3%
18.3%
.