摘要:31. (Ⅰ)实验结论 (Ⅱ)实验方法 (Ⅲ)实验现象 (1)CaO溶于水后溶 液显碱性 取少量CaO放入试管中.加入适量水溶解.再滴入酚酞试液 溶液变红 (2)用消石灰和硫酸铜溶液配制波尔多液时.硫酸铜溶液过量 取少量配制的液体.向其中插入一根铁丝 铁丝表面覆盖一层红色固体 (4)某可燃性气体是 CO不是H2 点燃.将产物通入澄清石灰水中 石灰水变白色浑浊
网址:http://m.1010jiajiao.com/timu3_id_104414[举报]
气体的实验室制法是一种重要的实验基本技能,请回顾二氧化碳的实验室制法,回答下列问题:
(1)化学反应能生成二氧化碳的反应很多,如见下面反应
①C+O2
CO2
②Na2CO3+2HCl=2NaCl+H20+CO2↑
③CaCO3+2HCl=2CaCl2+H20+CO2↑
④CaC2O4
CaO+CO↑+CO2↑
⑤CO+Fe2O3
2Fe+3CO2
…
请任意分析上面一个不适合于实验制取二氧化碳的反应的原因:
(2)盐酸密度(20℃时)和其溶质质量分数之间的关系
①分析上述数据可得到一个结论:
②现要配制200ml溶质质量分数为8.5%的稀盐酸用于制取二氧化碳,则需要溶质质量分数为37.2%的浓盐酸
(3)下面是二氧化碳的制取、净化、收集和量气的相关实验
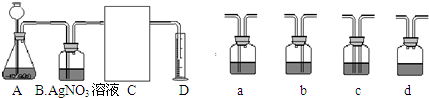
(温馨提示:C装置中装饱和碳酸氢钠溶液,二氧化碳不溶于饱和碳酸氢钠溶液)
①A中的长颈漏斗如果用分液漏斗代替的好处是
②实验过程B装置产生的主要实验现象是:
涉及化学反应是
③方线框中的C装置应该选择上面提供的a、b、c、d的
查看习题详情和答案>>
(1)化学反应能生成二氧化碳的反应很多,如见下面反应
①C+O2
| ||
②Na2CO3+2HCl=2NaCl+H20+CO2↑
③CaCO3+2HCl=2CaCl2+H20+CO2↑
④CaC2O4
| ||
⑤CO+Fe2O3
| ||
…
请任意分析上面一个不适合于实验制取二氧化碳的反应的原因:
反应②Na2CO3+2HCl═2NaCl+H20+CO2↑该反应速率太快,不利于收集
反应②Na2CO3+2HCl═2NaCl+H20+CO2↑该反应速率太快,不利于收集
.现提供有①纯净的CaCO3白色粉末,②大理石,③稀盐酸,③浓盐酸,④稀硫酸,⑤浓硫酸.其中最适合用于实验室制取二氧化碳的药品是②③
②③
(填代号)(2)盐酸密度(20℃时)和其溶质质量分数之间的关系
| 密度(ρ)/g?ml-1 | 1.00 | 1.02 | 1.04 | 1.06 | 1.08 | 1.10 | 1.12 | 1.14 | 1.16 | 1.185 |
| 溶质质量分数(w)/% | 0.4 | 4.4 | 8.5 | 12.5 | 16.5 | 20.4 | 24.2 | 28.2 | 32.2 | 37.2 |
溶液质量分数越大,其密度也越大
溶液质量分数越大,其密度也越大
;盐酸是氯化氢气体溶于水得到的溶液,升高盐酸溶液的温度,其密度将变减小
减小
.②现要配制200ml溶质质量分数为8.5%的稀盐酸用于制取二氧化碳,则需要溶质质量分数为37.2%的浓盐酸
40.1mL
40.1mL
ml.配制过程中要用到量筒、胶头滴管
胶头滴管
、烧杯、玻璃棒等仪器.(3)下面是二氧化碳的制取、净化、收集和量气的相关实验

(温馨提示:C装置中装饱和碳酸氢钠溶液,二氧化碳不溶于饱和碳酸氢钠溶液)
①A中的长颈漏斗如果用分液漏斗代替的好处是
分液漏斗比长颈漏斗能更方便的控制反应速率
分液漏斗比长颈漏斗能更方便的控制反应速率
②实验过程B装置产生的主要实验现象是:
产生白色沉淀
产生白色沉淀
;涉及化学反应是
AgNO3+HC═lAgCl↓+HNO3
AgNO3+HC═lAgCl↓+HNO3
.③方线框中的C装置应该选择上面提供的a、b、c、d的
a
a
.某化学实验小组在实验室用加热大理石(CaCO3)分解的方法制取生石灰(CaO).加热一段时间后,同学们对大理石是否分解提出怀疑.小组同学经研究决定对加热容器内剩余固体的成分进行探究,以证明大理石是否分解.请你参与探究.
实验限选的试剂:稀盐酸、蒸馏水、二氧化碳.
提出问题:加热大理石(CaCO3)后残留的固体成分是什么?
作出猜想:
猜想1:残留固体是CaCO3
猜想2:残留固体是CaO
猜想3:残留固体是______.
设计实验,按要求完成下表:
查看习题详情和答案>>
实验限选的试剂:稀盐酸、蒸馏水、二氧化碳.
提出问题:加热大理石(CaCO3)后残留的固体成分是什么?
作出猜想:
猜想1:残留固体是CaCO3
猜想2:残留固体是CaO
猜想3:残留固体是______.
设计实验,按要求完成下表:
| 实验步骤 | 预期的实验现象与结论 |
| 步骤1:取少量残留固体于试管中,加入一定量的 ②,振荡充分溶解,静置. | 若完全溶解,则说明原残留固体是③.若部分溶解,则原残留固体可能是④. |
| 步骤2:若步骤1中有未溶固体,则取上层清夜少许于试管中,通入CO2. | 若⑤则说明原残留固体中含有CaO,否则不含CaO. |
| 步骤3:若步骤1中有未溶固体,向该固体中加入⑥. | 若有气泡产生,则原残留固体中含有⑦.否则只含有⑧. |
某化学实验小组在实验室用加热大理石(CaCO3)分解的方法制取生石灰(CaO).加热一段时间后,同学们对大理石是否分解提出怀疑.小组同学经研究决定对加热容器内剩余固体的成分进行探究,以证明大理石是否分解.请你参与探究.
实验限选的试剂:稀盐酸、蒸馏水、二氧化碳.
提出问题:加热大理石(CaCO3)后残留的固体成分是什么?
作出猜想:
猜想1:残留固体是CaCO3
猜想2:残留固体是CaO
猜想3:残留固体是______.
设计实验,按要求完成下表:
查看习题详情和答案>>
实验限选的试剂:稀盐酸、蒸馏水、二氧化碳.
提出问题:加热大理石(CaCO3)后残留的固体成分是什么?
作出猜想:
猜想1:残留固体是CaCO3
猜想2:残留固体是CaO
猜想3:残留固体是______.
设计实验,按要求完成下表:
| 实验步骤 | 预期的实验现象与结论 |
| 步骤1:取少量残留固体于试管中,加入一定量的 ②,振荡充分溶解,静置. | 若完全溶解,则说明原残留固体是③.若部分溶解,则原残留固体可能是④. |
| 步骤2:若步骤1中有未溶固体,则取上层清夜少许于试管中,通入CO2. | 若⑤则说明原残留固体中含有CaO,否则不含CaO. |
| 步骤3:若步骤1中有未溶固体,向该固体中加入⑥. | 若有气泡产生,则原残留固体中含有⑦.否则只含有⑧. |
查看习题详情和答案>>
某化学实验小组在实验室用加热大理石(CaCO3)分解的方法制取生石灰(CaO).加热一段时间后,同学们对大理石是否分解提出怀疑.小组同学经研究决定对加热容器内剩余固体的成分进行探究,以证明大理石是否分解.请你参与探究.
实验限选的试剂:稀盐酸、蒸馏水、二氧化碳.
提出问题:加热大理石(CaCO3)后残留的固体成分是什么?
作出猜想:
猜想1:残留固体是CaCO3
猜想2:残留固体是CaO
猜想3:残留固体是________.
设计实验,按要求完成下表:
| 实验步骤 | 预期的实验现象与结论 |
| 步骤1:取少量残留固体于试管中,加入一定量的 ②,振荡充分溶解,静置. | 若完全溶解,则说明原残留固体是③.若部分溶解,则原残留固体可能是④. |
| 步骤2:若步骤1中有未溶固体,则取上层清夜少许于试管中,通入CO2. | 若⑤则说明原残留固体中含有CaO,否则不含CaO. |
| 步骤3:若步骤1中有未溶固体,向该固体中加入⑥. | 若有气泡产生,则原残留固体中含有⑦.否则只含有⑧. |
 碱石灰是实验室常用的干燥剂.同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究.
碱石灰是实验室常用的干燥剂.同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究. 【提出问题】实验室中久置的碱石灰样品的成分是什么?
【进行猜想】
久置的碱石灰样品中可能含有CaO、NaOH、Na2CO3、Ca(OH)2、CaCO3等成分.用化学方程式表示样品中含有Ca(OH)2或Na2CO3可能含有的原因
【探究过程】
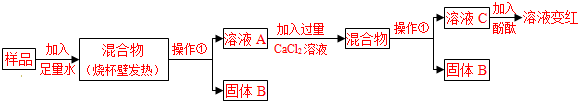
试回答下列问题:
(1)操作①的名称是
(2)溶液A中加入CaCl2溶液后产生固体,该反应的方程式为
(3)向溶液A中加入CaCl2溶液后,证明CaCl2溶液过量的方法是
【实验结论】
依据上述实验操作过程及现象,综合对滤液和固体成分的探究,下列对样品成分的分析正确的是
①样品中一定含NaOH ②样品中一定含Na2CO3 ③样品中含NaOH、CaO中的一种或两种
【拓展延伸】
(1)为测定实验室中一瓶变质的烧碱中NaOH的含量,某同学取50.0g烧碱样品,溶于一定量的水中得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g.请分析计算样品中NaOH的质量分数是多少?(写出计算过程)
(2)用同浓度的硫酸,分别与未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等.从钠元素质量守恒的角度解释其原因是: