摘要:17.现有如下化学实验方法:通入足量澄清石灰水 (C)检验燃烧后的产物 (D)在空气中充分灼烧.请从中选择适当方法的序号.写在各题题后的横线上 ①鉴别氢气和一氧化碳 ,②除去一氧化碳中少量的二氧化碳 , ③鉴别氧气和二氧化碳 ,④除去氧化铜中少量的铜 .
网址:http://m.1010jiajiao.com/timu3_id_101810[举报]
实验室制取气体的装置如图所示,根据所学知识,回答下列问题:

(1)图中标有①②的仪器名称:①
(2)写出用装置A制取氧气的一个化学方程式
(3)某同学用D装置集满一瓶氧气后,实验时发现氧气不纯,原因可能是
(4)实验室用石灰石和稀盐酸反应制取二氧化碳时,应选用图中
(5)实验室用锌粒与稀硫酸在常温下反应制取氢气,需选用的发生装置为
查看习题详情和答案>>

(1)图中标有①②的仪器名称:①
长颈漏斗
长颈漏斗
;②集气瓶
集气瓶
.(2)写出用装置A制取氧气的一个化学方程式
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
;A装置中试管口略向下倾斜的目的是
| ||
| △ |
防止冷凝水倒流引起试管破裂
防止冷凝水倒流引起试管破裂
.(3)某同学用D装置集满一瓶氧气后,实验时发现氧气不纯,原因可能是
集气瓶内未装满水
集气瓶内未装满水
.(4)实验室用石灰石和稀盐酸反应制取二氧化碳时,应选用图中
B
B
和C
C
来组装一套实验装置,检验二氧化碳集满的方法将燃着的木条放到集气瓶口,看是否熄灭
将燃着的木条放到集气瓶口,看是否熄灭
.(5)实验室用锌粒与稀硫酸在常温下反应制取氢气,需选用的发生装置为
B
B
,收集装置为D或E
D或E
.实验室常用亚硫酸钠(Na2SO3)固体与稀硫酸在常温下反应制二氧化硫气体.二氧化硫气体是无色有刺激性气味的有毒气体,它的密度比空气大,可溶于水生成亚硫酸(H2SO3)
(1)试写出实验室制取二氧化硫气体的化学方程式:(特别提示:该反应与碳酸钙和稀盐酸的化学反应原理相似)
(2)制取二氧化硫时,发生装置应选用如图所示的
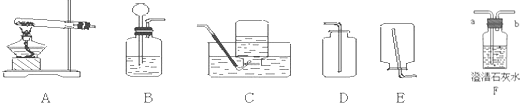
(3)二氧化硫气体与硫化氢气体常温下混合反应,生成黄色固体硫(单质)和水.试写出此反应的化学方程式
(4)实验室若选B装置作为制取O2和CO2的发生装置,请分别写出制取O2和CO2的反应的化学方程式
选择B装置制取CO2的理由是
(5)收集CO2应选择
(6)若要检验气体是否为CO2,应选择装置
查看习题详情和答案>>
(1)试写出实验室制取二氧化硫气体的化学方程式:(特别提示:该反应与碳酸钙和稀盐酸的化学反应原理相似)
Na2SO3+H2SO4=Na2SO4+H2O+SO2↑
Na2SO3+H2SO4=Na2SO4+H2O+SO2↑
(2)制取二氧化硫时,发生装置应选用如图所示的
B
B
装置(填代号,下同);收集二氧化硫气体时,应选用下图所示D
D
的装置.
(3)二氧化硫气体与硫化氢气体常温下混合反应,生成黄色固体硫(单质)和水.试写出此反应的化学方程式
SO2+2H2S=
SO2+2H2S=
3S↓+2H2O
3S↓+2H2O
(4)实验室若选B装置作为制取O2和CO2的发生装置,请分别写出制取O2和CO2的反应的化学方程式
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
、
| ||
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.选择B装置制取CO2的理由是
固体与液体在常温下反应
固体与液体在常温下反应
.(5)收集CO2应选择
D
D
装置,检验CO2收集满瓶的方法是将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了
将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了
.(6)若要检验气体是否为CO2,应选择装置
F
F
(填序号),气体应从a
a
(填“a”或“b”)处通入,该装置中观察到的实验现象是澄清的石灰水变浑浊
澄清的石灰水变浑浊
反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
.实验是学习化学的重要手段,通过实验可以培养实践能力和创新精神.
(一)实验室制取气体是初中重要的一组实验,结合下列实验装置图
回答有关问题:
(1)图中仪器A的名称是
(2)某同学用氯酸钾制取氧气,化学方程式为
(3)若要制取并收集一瓶CO2,应选择上图中的仪器
(二)工业上是用氨气还原氧化铜制取铜的.某校化学兴趣小组为探究该反应能否进行并验证其生成物,查阅了大量资料并设计了一系列实验.
【查阅信息】(1)氨气是一种无色、有刺激性气味的气体,不易燃,密度比空气小,极易溶于水,氨水显碱性.实验室常用加热氯化铵晶体和熟石灰固体混合物的方法制取氨气,同时生成氯化钙和水.
(2)氨气还原氧化铜制取铜的反应原理:2NH3+3CuO
3Cu+N2+3H2O
某小组设计了如图实验装置并进行实验:

试回答:
(1)写出装置A中试管内发生反应的化学方程式:
(2)装置B所起的作用是
(3)装置C中可观察到的实验现象是
(4)你认为该小组的实验设计还存在着哪些不足?
查看习题详情和答案>>
(一)实验室制取气体是初中重要的一组实验,结合下列实验装置图

回答有关问题:
(1)图中仪器A的名称是
集气瓶
集气瓶
.(2)某同学用氯酸钾制取氧气,化学方程式为
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
;
| ||
| △ |
(3)若要制取并收集一瓶CO2,应选择上图中的仪器
②③⑤⑨
②③⑤⑨
(填序号,如果有多种组合,填出一种组合即可).(二)工业上是用氨气还原氧化铜制取铜的.某校化学兴趣小组为探究该反应能否进行并验证其生成物,查阅了大量资料并设计了一系列实验.
【查阅信息】(1)氨气是一种无色、有刺激性气味的气体,不易燃,密度比空气小,极易溶于水,氨水显碱性.实验室常用加热氯化铵晶体和熟石灰固体混合物的方法制取氨气,同时生成氯化钙和水.
(2)氨气还原氧化铜制取铜的反应原理:2NH3+3CuO
| ||
某小组设计了如图实验装置并进行实验:

试回答:
(1)写出装置A中试管内发生反应的化学方程式:
2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑
| ||
2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑
.
| ||
(2)装置B所起的作用是
干燥氨气
干燥氨气
.(3)装置C中可观察到的实验现象是
黑色粉末变成红色
黑色粉末变成红色
.(4)你认为该小组的实验设计还存在着哪些不足?
没有尾气处理装置
没有尾气处理装置
.实验一、
如图是实验室制取气体的常用仪器.请根据要求填空:
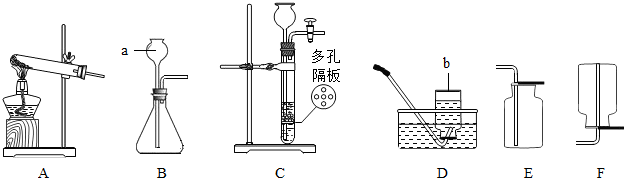
(1)写出图中仪器a、b的名称
(2)实验室用上图B装置来制取氧气,反应的化学方程式为
(3)已知氨气是一种无色有刺激性气味、极易溶于水、密度比空气小的气体.实验室常用加热氯化铵和熟石灰的固体混合物制取氨气,则其发生装置应选择
实验二、
小明同学设计了如图所示的实验装置,既可用于制取CO2,又可用于探究CO2的性质.
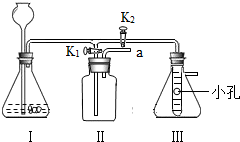
说明:
(1)装置Ⅰ中盛放的药品是石灰石和稀盐酸.
(2)装置Ⅲ中在小试管外壁贴有4片试纸:其中两端的两片用紫色石蕊溶液润湿,中间两片用紫色石蕊溶液浸过并晒干.
①实验时,打开K1关闭K2可用来制备CO2.写出Ⅰ中反应的化学方程式
②实验时,关闭K1打开K2可用于探究CO2的性质.实验时Ⅲ中出现的现象是
查看习题详情和答案>>
如图是实验室制取气体的常用仪器.请根据要求填空:

(1)写出图中仪器a、b的名称
长颈漏斗、集气瓶
长颈漏斗、集气瓶
.(2)实验室用上图B装置来制取氧气,反应的化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
,若用装置C来制备CO2,该装置的优点是
| ||
可随时控制反应的发生和停止
可随时控制反应的发生和停止
(3)已知氨气是一种无色有刺激性气味、极易溶于水、密度比空气小的气体.实验室常用加热氯化铵和熟石灰的固体混合物制取氨气,则其发生装置应选择
A
A
,收集装置应选择F
F
(填写装置的字母代号).实验二、
小明同学设计了如图所示的实验装置,既可用于制取CO2,又可用于探究CO2的性质.

说明:
(1)装置Ⅰ中盛放的药品是石灰石和稀盐酸.
(2)装置Ⅲ中在小试管外壁贴有4片试纸:其中两端的两片用紫色石蕊溶液润湿,中间两片用紫色石蕊溶液浸过并晒干.
①实验时,打开K1关闭K2可用来制备CO2.写出Ⅰ中反应的化学方程式
CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
;检验II中气体收集满的方法是将燃着的木条放至导管口a处,木条熄灭说明收集满
将燃着的木条放至导管口a处,木条熄灭说明收集满
.若在II中放入澄清的石灰水,可用于检验CO2,反应的化学方程式为Ca(OH)2+CO2═CaCO3↓+H2O
Ca(OH)2+CO2═CaCO3↓+H2O
.②实验时,关闭K1打开K2可用于探究CO2的性质.实验时Ⅲ中出现的现象是
干燥试纸无变化,湿润试纸由下至上依次变红
干燥试纸无变化,湿润试纸由下至上依次变红
;有关反应的化学方程式为CO2+H2O═H2CO3
CO2+H2O═H2CO3
;该实验说明CO2具有的性质是密度比空气大,能与水反应
密度比空气大,能与水反应
.实验是进行科学探究的重要方式,请根据如图回答问题:

(1)用A图所示装置进行电解水实验时,a管产生的气体是
(2)用B图所示装置测定空气中氧气的含量时,写出反应的化学方程式为
(3)利用C图所示方法,把二氧化碳气体慢慢倒入放有燃着的蜡烛的烧杯中,下层蜡烛的火焰先熄灭.说明二氧化碳具有的性质是
(4)当通过导管向热水中通入氧气时,白磷在水下燃烧.该实验说明燃烧需要的条件为:①可燃物;②达到燃烧所需要的
(5)①利用E图所示方法,对细铁丝在氧气中燃烧为什么会火星四射进行探究.如表不同含碳量的铁丝(所用铁丝直径均相同)放入氧气中燃烧时的实验现象:
由上表可分析出,“火星”可能是
②【查阅资料】细铁丝也可以在氯气中剧烈燃烧,放出大量的热,产生大量棕黄色的烟;镁条能在空气中剧烈燃烧,也能在二氧化碳中剧烈燃烧,发出耀眼的白光、放出大量的热.
根据上述内容和课本中对“燃烧”的描述,你认为
查看习题详情和答案>>

(1)用A图所示装置进行电解水实验时,a管产生的气体是
氢气
氢气
.(2)用B图所示装置测定空气中氧气的含量时,写出反应的化学方程式为
4P+5O2
2P2O5
| ||
4P+5O2
2P2O5
;该实验得到的结论是:
| ||
气中氧气约占空气体积的
| 1 |
| 5 |
气中氧气约占空气体积的
.| 1 |
| 5 |
(3)利用C图所示方法,把二氧化碳气体慢慢倒入放有燃着的蜡烛的烧杯中,下层蜡烛的火焰先熄灭.说明二氧化碳具有的性质是
不燃烧
不燃烧
、也不支持燃烧
也不支持燃烧
且密度比空气大,因此在实际生活中的应用为灭火
灭火
.(4)当通过导管向热水中通入氧气时,白磷在水下燃烧.该实验说明燃烧需要的条件为:①可燃物;②达到燃烧所需要的
着火点
着火点
;③有充足的氧气
氧气
.(5)①利用E图所示方法,对细铁丝在氧气中燃烧为什么会火星四射进行探究.如表不同含碳量的铁丝(所用铁丝直径均相同)放入氧气中燃烧时的实验现象:
| 铁丝中含碳量 | 0.05% | 0.2% | 0.6% |
| 燃烧时的现象 | 剧烈燃烧,极少火星 | 剧烈燃烧,少量火星 | 剧烈燃烧,大量火星 |
铁中含有的碳
铁中含有的碳
与氧气反应所导致的.②【查阅资料】细铁丝也可以在氯气中剧烈燃烧,放出大量的热,产生大量棕黄色的烟;镁条能在空气中剧烈燃烧,也能在二氧化碳中剧烈燃烧,发出耀眼的白光、放出大量的热.
根据上述内容和课本中对“燃烧”的描述,你认为
发光、放热的剧烈化学反应
发光、放热的剧烈化学反应
叫燃烧.