网址:http://m.1010jiajiao.com/timu3_id_100213[举报]
(1)如图所示为实验室常用的制取氧气的实验装置,据此回答下列问题:
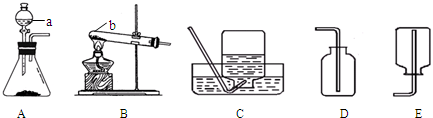
①写出图中标号的仪器名称:a
②化学实验绿色化的特点是:原料、产物、条件无毒无害,提高原子的利用率.从绿色化学的理念考虑,应选择A装置制氧气,请写出用该装置制取氧气的文字表达式(或化学表达式)
| ||
| ||
③制氧气可选用的收集装置是
④通过查阅资料得知:a.在实验室中,常用加热氯化铵(固体)和熟石灰(固体)混合物的方法制取氨气;b.氨气是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水;则实验室制取氨气时应选择的发生装置是
(2)小明对妈妈杀鱼时从鱼肚内取出的鳔(见下图)产生了兴趣,他确定了“探究鳔内气体
体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占1/4,其余主要是二氧化碳和氮气.探究分两步进行.
①测量鳔内气体体积.小明设计了两种方法:
A:用医用注射器抽取鳔内气体,测量其体积;
B:在水下剌破鳔,用排水集气法收集鳔内气体并测量其体积(如图).
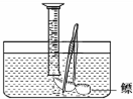
你认为这两种方法中不合理的是
②探究鳔内气体的成分.给你一集气瓶的鳔内气体,请你帮助他设计实验验证假设.
| 方法 | 现象 | 结论 | |
| 验证鳔 内含O2 |
用燃烧的木条检验 用燃烧的木条检验 |
木条能继续燃烧 木条能继续燃烧 |
鳔内含有氧气 鳔内含有氧气 |
①过氧化钙的相对分子质量为
②过氧化钙中钙、氧元素的质量比为
③72克过氧化钙与多少克二氧化碳中含氧元素质量相等?
计算过程:
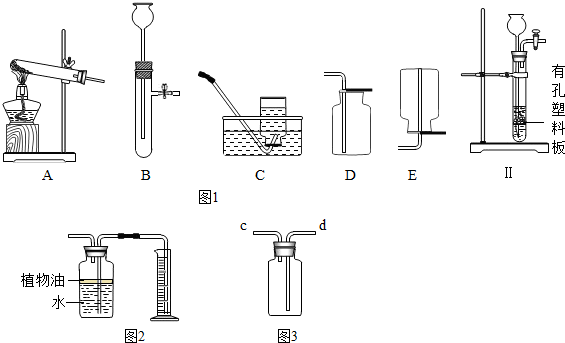
(1)按要求从图1以上A-E装置中选择(填装置的序号).小镁同学要用高锰酸钾加热制取并收集O2应选择
| ||
| ||
| ||
| ||
(2)小松同学改进B装置后,设计出如图Ⅱ装置,此装置的优点是:
(3)小松同学使用图2装置制取CO2,现有①粉末状石灰石;②块状大理石;③稀HCl;④稀H2SO4四种试剂,应选用的试剂是
(4)验证二氧化碳气体己收集满的方法是
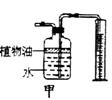
(5)图2装置可用来测量生成的C02气体的体积,其中在水面上放一层植物油的目的是
(6)氨气(NH3)在通常状况下是一种无色有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液为氨水.实验室可用加热氯化铵和熟石灰两种固体混合物的方法制取氨气.实验室制取氨气应选用的发生装置是
装置收集氨气,气体应从
(7)根据上述分析和选择可知,实验室制取气体选择发生装置的依据是
 某化学兴趣小组在老师指导下,进行了“H2O2生成O2的快慢与什么因素有关”的实验.请你帮助回答下列问题.(实验均在20℃室温下进行)
某化学兴趣小组在老师指导下,进行了“H2O2生成O2的快慢与什么因素有关”的实验.请你帮助回答下列问题.(实验均在20℃室温下进行)(1)“用过氧化氢和二氧化锰制氧气”的反应方程式为:
| ||
| ||
③向大试管内倒入适量过氧化氢再加入少许MnO2粉末用试管进行排水法集气时,出现如图所示的3种操作,其中合理的是
若要证明MnO2是该反应的催化剂,还需要增加实验来验证MnO2在反应前后的化学性质和
(2)假设H2O2生成O2的快慢与催化剂种类有关.在两瓶等体积6%的H2O2溶液中分别加入相同质量MnO2和红砖粉,测量各生成一瓶(相同体积)O2所需要的时间.记录数据如下:
| 实验编号 | 1 | 2 |
| 反应物 | 6% H2O2 | 6% H2O2 |
| 催化剂 | 1g红砖粉 | 1g MnO2 |
| 时间(s) | 152 | 35 |
(3)假设H2O2生成O2的快慢与不同质量分数的H2O2溶液有关.
在不同质量分数的H2O2溶液进行实验.记录数据如下:
| 实验编号 | 1 | 2 | 3 |
| H2O2溶液的溶质质量分数 | 5% | 10% | 20% |
| MnO2粉末用量(g) | 0.2 | ||
| 收集到500mL气体时所用时间(s) | 205 | 80 | 9 |
| 反应后溶液的温度(℃) | 39 | 56 | 67 |
(4)还有哪些因素可能影响该反应快慢?
请说出你的一个猜想:
某化学课外活动小组进行了一系列的实验,请按要求作答:
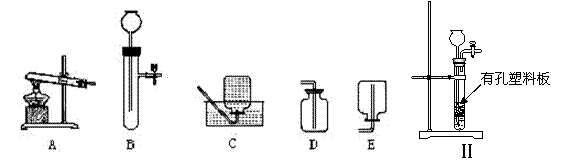
(1)按要求从以上A — E装置中选择(填装置的序号)。小镁同学要用高锰酸钾加热制取并收集O2应选择 装置,反应的化学方程式为 ; B装置也可用于制取O2,反应的化学方程式为 ;
(2) 小松同学改进B装置后,设计出如图(Ⅱ)装置,此装置的优点是: ;
(3)小松同学使用图(Ⅱ)装置制取CO2,现有①粉末状石灰石;②块状大理石;③稀HCl;④稀H2SO4四种试剂,应选用的试剂是 (填序号)。
(3) 验证二氧化碳气体己收集满的方法是______________________________
(4) 甲图装置可用来测量生成的C02气体的体积,其中在水面上放一层植物油的目的是_______________,植物油上方原有的空气对实验的结果 (填“有”或“没有”)明显影响。
(5) 氨气(NH3)在通常状况下是一种无色有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液为氨水。实验室可用加热氯化铵和熟石灰两种固体混合物的方法制取氨气。实验室制取氨气应选用的发生装置是_______(填字母),若用乙图装置收集氨气,气体应从______端导气管进入瓶 中
中
(填字母)。
(6) 根据上述分析和选择可知,实验室制取气体选择发生装置的依据是 。若用排空气法收集气体,导气管应伸入 集气瓶底部,否则 ;小明同学建议用装置B做“H202分解制取02”实验,但遭到很多同学的质疑,你认为用该装置制取02的缺点是 ,小红将仪器作一简单的调整即得到目的,小红的做法是 。
集气瓶底部,否则 ;小明同学建议用装置B做“H202分解制取02”实验,但遭到很多同学的质疑,你认为用该装置制取02的缺点是 ,小红将仪器作一简单的调整即得到目的,小红的做法是 。
 某校化学兴趣小组对金属活动性顺序等知识进行了研究.
某校化学兴趣小组对金属活动性顺序等知识进行了研究.
