摘要:.下表是A物质在t℃时的溶解度测定表.请按要求答题: 温 度℃ 0 10 20 30 40 50 60 溶解度(g) 13 20 31 45 63 85 110 ① 在坐标中绘制A物质的溶解度曲线 ② 交点的意义是 ③ 从中你还能读出的化学停息是
网址:http://m.1010jiajiao.com/timu3_id_100188[举报]
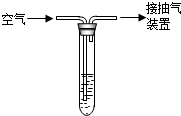 硫或含硫物质在空气中燃烧生成SO2,SO2是一种无色、有刺激性气味的有毒气体.
硫或含硫物质在空气中燃烧生成SO2,SO2是一种无色、有刺激性气味的有毒气体.(1)下列环境问题与SO2的排放有关的是
A.温室效应 B.酸雨 C.白色污染 D.臭氧空洞
(2)某工厂每天燃烧含硫1%的煤200t,若某煤中的硫全部转化为SO2,则该工厂每天产生SO2
(3)产生SO2的途径很多.小明在实验室选取足量锌与适量的浓硫酸反应制取SO2,反应
的化学方程为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,反应一段时间后,老师指出还可能生成另外一种气体.请根据锌的化学性质,推断出此气体的名称,并解释其原因.
(4)我国的环境空气质量标准中对空气中SO2最高浓度(单位体积的空气中所含SO2的质量)限值如下表所示:
| 浓度限值(mg/m3) | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
以下是常见的实验装置图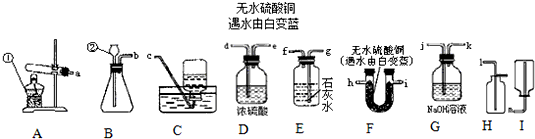
(1)图中有标号的仪器名称是:①________ ②________
(2)制取并收集干燥的CO2气体,选用的装置组合是________(填装置字母代号,下同),检验是否收集满的方法是________.制取该气体的化学方程式是________;小明建议将稀盐酸换成浓盐酸,你认为此方法可行吗?________(填“可行”或“不可行”),理由是________.
(3)某化学研究性小组的同学选用上述装置对常见化肥进行了探究:
碳酸氢铵(NH4HCO3)是一种常见的________肥,受热易分解生成三种化合物,其中一种是氨气(NH3),另两种可能是________、________;为了证明此猜想,选择上述部分装置,各接口的连接顺序是a接________接________接________.
(4)如用H2O2和MnO2制氧气,应选用________作为发生装置,其化学反应方程式为________.
对此实验,让我们继续思考并研究几个问题:
问题①:催化剂MnO2的用量对反应速率有没无影响,我的实验方案是:每次均用30mL10%的H2O2溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| MnO2粉末用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 |
| 所用时间(t) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 |
答:________.
问题②:H2O2溶液的溶质质量分数对反应速率有没有影响,你的实验方案是:
答:________.
问题③:还有哪些因素可能影响该反应的速率呢?
请说出你的一个猜想:________.
问题④:已知氧气在该实验条件下的密度为1.28g/L,若要制取250mL氧气,计算理论上至少需要消耗30%的H2O2溶液多少克?(相对原子质量:H-1O-16) 查看习题详情和答案>>
(2006?建邺区一模)以下是常见的实验装置图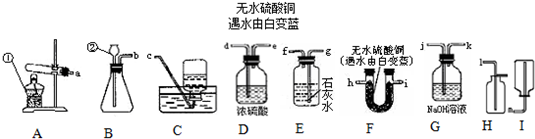
(1)图中有标号的仪器名称是:①
(2)制取并收集干燥的CO2气体,选用的装置组合是
(3)某化学研究性小组的同学选用上述装置对常见化肥进行了探究:
碳酸氢铵(NH4HCO3)是一种常见的
(4)如用H2O2和MnO2制氧气,应选用
对此实验,让我们继续思考并研究几个问题:
问题①:催化剂MnO2的用量对反应速率有没无影响,我的实验方案是:每次均用30mL10%的H2O2溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
请你分析表中数据回答:MnO2的用量对反应速率有无影响,如果有,怎样影响?
答:
问题②:H2O2溶液的溶质质量分数对反应速率有没有影响,你的实验方案是:
答:
问题③:还有哪些因素可能影响该反应的速率呢?
请说出你的一个猜想:
问题④:已知氧气在该实验条件下的密度为1.28g/L,若要制取250mL氧气,计算理论上至少需要消耗30%的H2O2溶液多少克?(相对原子质量:H-1O-16)
查看习题详情和答案>>

(1)图中有标号的仪器名称是:①
酒精灯
酒精灯
②长颈漏斗
长颈漏斗
(2)制取并收集干燥的CO2气体,选用的装置组合是
BDH或BFH
BDH或BFH
(填装置字母代号,下同),检验是否收集满的方法是将燃着的木条放在瓶口,观察是否熄灭
将燃着的木条放在瓶口,观察是否熄灭
.制取该气体的化学方程式是CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
;小明建议将稀盐酸换成浓盐酸,你认为此方法可行吗?不可行
不可行
(填“可行”或“不可行”),理由是浓盐酸具有挥发性,使CO2中混入HCl气体
浓盐酸具有挥发性,使CO2中混入HCl气体
.(3)某化学研究性小组的同学选用上述装置对常见化肥进行了探究:
碳酸氢铵(NH4HCO3)是一种常见的
氮
氮
肥,受热易分解生成三种化合物,其中一种是氨气(NH3),另两种可能是CO2
CO2
、H2O
H2O
;为了证明此猜想,选择上述部分装置,各接口的连接顺序是a接h
h
接i
i
接g
g
.(4)如用H2O2和MnO2制氧气,应选用
B
B
作为发生装置,其化学反应方程式为2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
对此实验,让我们继续思考并研究几个问题:
问题①:催化剂MnO2的用量对反应速率有没无影响,我的实验方案是:每次均用30mL10%的H2O2溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| MnO2粉末用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 |
| 所用时间(t) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 |
答:
有影响,在一定范围内,MnO2的用量越大,反应越快
有影响,在一定范围内,MnO2的用量越大,反应越快
.问题②:H2O2溶液的溶质质量分数对反应速率有没有影响,你的实验方案是:
答:
每次用等量的MnO2,采用足量不同溶质质量分数的H2O2溶液进行实验,观察收集等量气体时所消耗的时间
每次用等量的MnO2,采用足量不同溶质质量分数的H2O2溶液进行实验,观察收集等量气体时所消耗的时间
.问题③:还有哪些因素可能影响该反应的速率呢?
请说出你的一个猜想:
MnO2颗粒大小有关
MnO2颗粒大小有关
.问题④:已知氧气在该实验条件下的密度为1.28g/L,若要制取250mL氧气,计算理论上至少需要消耗30%的H2O2溶液多少克?(相对原子质量:H-1O-16)
(1)下图所示a、b、c、d四个点,表示可燃物容易着火的点是 ____ 点(填字母序号)。

(2)请根据下列反应的微观示意图分析:

参加反应的化合物A与化合物B的分子个数比为________,生成物中单质分子与化合物分子的个数比为________。
(3)将一定质量的氯酸钾(不含催化剂)置于试管中加热一段时间,冷却后测得所得固体中氯元素的质量分数为35.5%,则反应中已分解的氯酸钾的质量分数为_______%。
(4)请根据下列图示回答问题:
(3)将一定质量的氯酸钾(不含催化剂)置于试管中加热一段时间,冷却后测得所得固体中氯元素的质量分数为35.5%,则反应中已分解的氯酸钾的质量分数为_______%。
(4)请根据下列图示回答问题:

①甲图中R物质在室温(20℃)时的饱和状态为D点,40℃时的饱和状态为A点,现将甲图中的R溶液从A状态变到B状态,请设计并简述两个简单的实验操作途径: a._____、 b.______; c.A状态由两种不同途径变到B状态时,溶液的溶质质量分数是否相等_________ (填“是” 或“否”)。
(填“是” 或“否”)。
②乙图是表示M、N两种物质饱和溶液的溶质质量分数随温度变化的曲线。现分别向50g M、80g N固体中各加入150g水,并加热至完全溶解,同时各蒸发掉50g水,冷却至t℃,下列分析正确的是________(填序号)。
a.只有N析出晶体; b.M、N两种溶液的溶质质量分数相等; c.只有M析出晶体: d.M、N均有晶体析出: e.M、N两种物质的溶解度相同。
查看习题详情和答案>>
 (填“是” 或“否”)。
(填“是” 或“否”)。 ②乙图是表示M、N两种物质饱和溶液的溶质质量分数随温度变化的曲线。现分别向50g M、80g N固体中各加入150g水,并加热至完全溶解,同时各蒸发掉50g水,冷却至t℃,下列分析正确的是________(填序号)。
a.只有N析出晶体; b.M、N两种溶液的溶质质量分数相等; c.只有M析出晶体: d.M、N均有晶体析出: e.M、N两种物质的溶解度相同。
1)下图所示a、b、c、d四个点,表示可燃物容易着火的点是 点(填字母序号)。

(2)请根据下列反应的微观示意图分析:

参加反应的化合物A与化合物B的分子个数比为——,生成物中单质分子与化合
物分子的个数比为——。
(3)将一定质量的氯酸钾(不含催化剂)置于试管中加热一段时间,冷却后测得所得固体
中氯元素的质量分数为35.5%,则反应中已分解的氯酸钾的质量分数为——%。
(4)请根据下列图示回答问题:

①甲图中R物质在室温(20℃)时的饱和状态为D点,40℃时的饱和状态为A点,现将
甲图中的R溶液从A状态变到B状态,请设计并简述两个简单的实验操作途径:
a.——、 b.——; c.A状态由两种不同途径变到B状态时,溶液的溶质质量分数是否相等———(填“是” 或“否”)。
②乙图是表示M、N两种物质饱和溶液的溶质质量分数随温度变化的曲线。现分别向50g M、80g N固体中各加入150g水,并加热至完全溶解,同时各蒸发掉50g水,冷却至t℃,下列分析正确的是———(填序号,多选、少选、错选均不给分)。
a.只有N析出晶体; b.M、N两种溶液的溶质质量分数相等;
c.只有M析出晶体: d.M、N均有晶体析出:
e.M、N两种物质的溶解度相同。
查看习题详情和答案>>