高一化学同步测试化学键
YCY
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.共100分,考试用时60分钟.
第Ⅰ卷(选择题,共50分)
以下数据可供解题时参考:
相对原子质量 Al 27
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.某元素的原子最外层只有一个电子,它跟卤素相结合时,可形成的化学键 ( )
A.一定是共价键 B.一定是离子键
C.可能是共价键,也可能是离子键 D.上述说法都不正确
2. 关于共价键的下列叙述, 正确的是 ( )
A.通过共价键相结合的原子之间只存在强烈的相互吸引
B.共价键的键长越长, 共价键越稳定
C.拆开1 mol某共价键时需要吸收的能量, 是该共价键的键能
D.共价键的键能越大, 该共价键越不稳定, 越易拆开
3.下列说法中正确的是 ( )
A.分子中键能越大,键越长,则分子越稳定
B.失电子难的原子获得电子的能力一定强
C.在化学反应中,某元素由化合态变为游离态,该元素被还原
D. 电子层结构相同的不同离子,其半径随核电荷数增多而减小
4.下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是 ( )
A.6和8 B.11和
5.下列性质中,可以证明某化合物内一定存在离子键的是 ( )
A.可溶于水 B.具有较高的熔点 C.水溶液可以导电 D.熔融状态能导电
6.下列说法正确的是: ( )
A.含有非极性键的分子一定是非极性分子
B.非极性分子中一定含有非极性键
C.由极性键构成的双原子分子一定是极性分子
D.键的极性与分子的极性无关
7.下列物质中,含有极性共价键的是 ( )
(1)N2 (2)H2O (3)CCl4 (4)Na2O2 (5)NaOH (6)Na2O
A.(1)(2)(3) B.(4)(5)(6) C.(2)(3)(5) D.(2)(4)(6)
8.对于CH4、NH3和H2O三种分子,下列关系中正确的是 ( )
①键长: O-H>N-H>C-H ②键角CH4>NH3>H2O ③键能: O -H>N-H>C-H ④稳定性: CH4<NH3<H2O⑤分子中孤对电子数CH4<NH3<H2O
A.①②③④⑤ B.①②④⑤ C.①③⑤ D.②③④⑤
9.下列各分子中,所有原子都满足最外层为8电子结构的是 ( )
A.H2O B.BF
10.M元素的一个原子失去2个电子,该2个电子转移到Y元素的2个原子中去,形成离子化合物Z,下列说法中,正确的是 ( )
A.Z的熔点较低 B.Z可表示为M2Y
C.Z一定溶于水中 D.M形成+2价阳离子
二、选择题(本题包括5小题,每小题4分,共20分。在每题给出的四个选项中,有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确给满分,但只要选错一个该小题就为0分)
11.下列说法正确的是 ( )
A.含有离子键的化合物一定是离子化合物
B.共价化合物中只有极性键
C.含有共价键的化合物一定是共价化合物
D.非极性键只存在于单质分子中
12.1999年曾报道合成和分离了含高能量的正离子N5+的化合物N5AsF6,下列叙述错误的是
( )
A.N5+正离子共有34个核外电子 B.N5+中氮―氮原子间以共用电子对结合
C.化合物N5AsF6中As化合价为+1 D.化合物N5AsF6中F化合价为-1
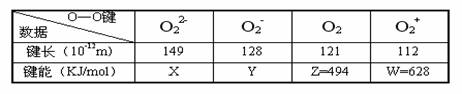 13.从实验测得不同物质中O―O之间的键长和键能的数据为: ( )
13.从实验测得不同物质中O―O之间的键长和键能的数据为: ( )
其中X、Y的见能数据尚未测定,但可根据规律性推导键能的大小顺序为:
W>Z>Y>X。该规律性是 ( )
A.成键时电子数越多,键能越大 B.键长越长,键能越小
C.成键所用电子数越少,键能越大 D.成键时电子对越偏移,键能越大
14.下列化学用语正确是 ( )
A.氟化钠的电子式 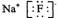 B. 四氯化碳
B. 四氯化碳 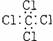
C. OH―的电子式: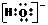 D.次氯酸的电子式:
D.次氯酸的电子式: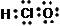
15.A元素原子的L电子层比B元素原子的L电子层少3个电子,B元素原子核外总电子数比A元素原子电子总数多5个,则A、B形成化合物可能是 ( )
A.离子化合物AB B.离子化合物B
C.离子化合物B(AO3)2 D.离子化合物A2BO3
第Ⅱ卷(非选择题,共50分)
三、填空、简答和计算(共8个小题,满分50分)
16.(9分)(1)在NaCl、NaOH、Na2O2、N2、H2S、H2O2中, 只含有离子键的是 ,只含有极性键的是 ,只含有非极性键的是 ,既含有离子键又含有极性键的是 ,既含有离子键又含有非极性键的是
(2) 用电子式表示下列物质的形成过程:
MgCl2 ________________________________________
H2O___________________________________________
17.(4分)周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1:2的离子化合物。写出这些化合物的化学式 。
18.(6分)溴化碘(IBr)的化学性质类似于卤族单质,试回答下列问题:
(1)IBr的电子式_____________,IBr属 ______化合物。(填“离子”或“共价”,下同)
(2)溴化碘和金属镁反应生成物属于_______化合物,生成物之一的电子式 。
(3)溴化碘和水反应生成一种三原子分子,该分子的电子式为__________,其分子中的化学键类型为___________。
19.(8分)(1)下列结构图中,代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),不黑点代表未用于形成共价键的最外层电子,短线代表价键,
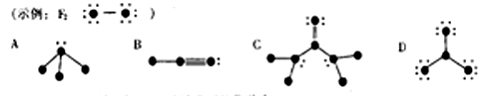
根据各图表示的结构特点,写出该分子的化学式:
A:________ B:_________ C:________ D:________
(2)试用上述方法表示NCl3、CO2的分子结构。
________、_______
20.(8分)m、n、x、y四种主族元素在周期表里的相对位置如下图所示。
|
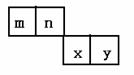

 ;共价。
;共价。
 ;共价。
;共价。


 (3)NaOH
(3)NaOH 

 、
、
