高一化学同步测试碱金属元素
说明:本卷答题时间60分钟,满分100分。
以下数据可供解题时参考:
相对原子质量:H:1 O:16 Li:7 Na:23 K:39 Rb:85
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.钾和钠的性质相似,下列说法中能较好地解释这个事实的是 ( )
A.最外层电子数相同 B.都是金属元素
C.原子半径相差不大 D.最高化合价相同
2.下列不属于碱金属单质的通性的是 ( )
A.硬度小、密度小、熔点低 B.导热导电性能强
C.焰色反应颜色相近 D.强还原性
3.按Li、Na、K、Rb、Cs的顺序性质递变依次减弱或减小的是 ( )
A.原子半径 B.密度
C.单质的还原性 D.熔点和沸点
4.下列关于锂的性质的推测不正确的是 ( )
A.它是一种活泼金属 B.投入冷水中能浮在水面上
C.投入到冷水中立即燃烧 D.它的氢氧化物是可溶性碱
5.下列关于碱金属的原子结构和性质的叙述中不正确的是 ( )
A.最层都只有一个电子,在化学反应中容易失去
B.都是强还原剂
C.都能在O2里燃烧生成过氧化物
D.都能与水反应生成碱
6.碱金属单质的活动性Li<Na<K<Rb<Cs的根本原因是 ( )
A.它们的熔点、沸点依次减小 B.原子最外层都有一个电子
C.它们的原子半径越来越大 D.它们与H2O反应越来越剧烈
7.用铂丝做焰色反应实验,每次做完后都需要 ( )
A.用盐酸洗涤,再灼烧至跟酒精灯火焰颜色相同后再使用
B.用水洗涤2~3次后再使用
C.用滤纸擦干净即可使用
D.用盐酸洗涤,再用自来水洗净后使用
8.用洁净的铂丝蘸取某无色溶液,进行焰色反应实验,直接观察时,火焰呈黄色,隔蓝色钴玻璃观察,火焰呈浅紫色,下列有关该无色溶液的叙述中正确的是 ( )
A.一定是钾和钠的混合物 B.一定含K+,可能含Na+
C.一定含Na+,可能含K+ D.既含K+,又含Na+
9.某碱金属
A.锂 B.钠 C.钾 D.铷
10.已知钡的活动性处于钾和钠之间,则下述说法中正确的是 ( )
A.钡可从氯化钾溶液中置换出钾 B.钡可从冷水中置换也氢
C.钡可从氯化钠溶液中置换出钠 D.钡在空气中燃烧生成Ba2O2
二、选择题(本题包括5小题,每小题4分,共20分。在每题给出的四个选项中,有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确给满分,但只要选错一个该小题就为0分)
11.下列关于铯的叙述正确的是 ( )
A.硫酸铯是一种可溶性离子化合物
B.碳酸氢铯加热能迅速分解,碳酸铯受热不分解
C.铯能在氧气中燃烧生成氧化铯
D.在自然界中有少量游离态的铯存在
12.下列关于碱金属某些性质的排列中,正确的是 ( )
A.原子半径:Li<Na<K<Rb<Cs B.密度:Li<Na<K<Rb<Cs
C.熔点、沸点:Li<Na<K<Rb<Cs D.还原性:Li>Na>K>Rb>Cs
13.LiH是一种氢气发生剂,用于军事或其他需氢气的场合。反应为:
LiH+H2O LiOH+H2↑在这个反应中
( )
LiOH+H2↑在这个反应中
( )
A.水是氧化剂,LiH是还原性
B.LiH是氧化剂,水是还原剂
C.LiH既是氧化剂又是还原剂
D.该反应是非氧化还原反应,不存在氧化剂和还原性
14.当质量为a g的某碱金属单质X与足量的氯气反应时,生 成氯化物质量为(a+35.5) g,若将等质量的碱金属单质X与氧气反应,生成化合物的质量可能为 ( )
A.(a+8)g B.(a+16)g C.(a+24)g D.(a+64)g
15.一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如右图所示,
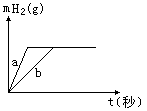 则下列说法中正确的是
( )
则下列说法中正确的是
( )
A.投入的Na、K一定等质量
B.投入的Na的质量小于K的质量
C.曲线a为Na,b为K
D.稀盐酸的量一定是不足量的
三、填空、简答和计算(共7个小题,50分)
16.(7分)碱金属原子的最外电子层都有______个电子,容易_______(填“失去”或“得到”)电子形成稳定的离子结构,表现化合价为______价;在Li、Na、K、Rb、Cs等五种元素中,随着核电荷数的增加,原子半径_____________,原子核对核外电子的引力____________,元素的原子失去电子的能力__________, 氧化物的水化物碱性最强的是_____________。
17.(5分)(1)下列对焰色反应实验操作注意事项说明正确的是_______________
①K的火焰颜色要透过蓝色的钴玻璃观察
②先灼烧铂丝到与原来火焰颜色相同时,再蘸被检物质
③每次实验后要将铂丝用盐酸洗净,并在火焰上灼烧到没有颜色为止
④没有铂丝可以用光洁无锈的铁丝代替
(2)进行焰色反应检验K+时有以下步骤:①蘸取待测夜;②置于酒精灯焰上灼烧;③透过蓝色钴玻璃观察;④用稀盐酸洗净铂丝,其中正确的操作顺序是________________
18.(7分)超氧化钾(KO2)常用于急救器中,它能吸收二氧化碳生成碳酸盐和氧气,这个反应的化学方程式为_________________________________________________。若用
19.(5分)用洁净的铂丝蘸取某淡黄色粉末在无色火焰上燃烧时,火焰呈黄色。另取少量粉末放入试管中,加入少量水,有气泡产生,这种气体能使带火星的木条复燃。向该水溶液中滴入酚酞试液,溶液变红。推断这种淡黄色粉末是什么物质,写出有关反应的化学方程式。
①该物质的名称是________________________
②该物质与水反应的化学方程式为 __________________________________,反应中氧化剂是 _____________还原剂是___________
20.(6分)有一包固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、BaCl2、K2CO3和K2SO4中的一种或几种.现按下列步骤进行实验:
(1)将该粉末溶于水得无色溶液和白色沉淀;
(2)在滤出的沉淀中加入稀硝酸后,有部分沉淀溶解,同时产生无色气体;
(3)取滤液做焰色反应,火焰呈黄色,隔蓝色钴玻璃观察,未见紫色火焰。
由上述实验现象推断:混合物一定含有__________;一定不含有__________;不能肯定是否含有__________.
21.(6分)有
22.(14分)今有某碱金属R及其氧化物R2O的混合物
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
A
C
D
C
C
C
A
D
C
B
二、选择题
题号
11
12
13
14
15
答案
AB
A
A
AB
B
三、填空、简答和计算
16.1, 失去,+1;增大,减弱,增强;Cs 。
17.(1) ①②③④ (2) ①②③④②
18. 4KO2+2CO2==2K3CO3+3O2 , 48 , 0.6 , 能。
19.(1)过氧化钠 (2)2Na2O2+2H2O==4NaOH+O2↑, Na2O2 ,Na2O2。
20.Na2CO3、Na2SO4、BaCl2;CuCl2、K2CO3、K2SO4;NaCl。
21.设合金中含有K和与水反应生成H2的质量分别为x和y.
2K + 2H2O==2KOH + H2↑ 2 Na + 2H2O==4NaOH + H2↑
78 2 46 2
39x x 23y y
则有:x+y=
39x+23y=
联立①②,解得x=
所以钠的质量分数:w(Na)=0.544X23/69.3=0.181
合金中钾、钠的原子个数比= ∶
∶ =233∶87
=233∶87
答:合金中钠的质量分数为0.181,钾和钠原子个数比为233∶87。
22.解:设此碱金属的相对原子质量为M,则
假设
R ~ ROH
M (17+M)
M:(17+M)=10.8:16, M=35.3
假设
R2O ~ 2ROH
(
(
由平均值原理,10.7<M<35.3,符合此条件的碱金属为钠(23)。
设

解之得:x=
答:该碱金属是钠,其混合物中Na为