金属元素单质的性质和制法
教学目标
知识技能:根据金属元素在周期表中的位置和原子结构特征,归纳、整理金属单质的性质和制法内在规律。
能力培养:通过分析和讨论,培养学生对金属单质性质和制法进行归纳重组,统摄整理和综合演绎能力,并能做“意义记忆”和“逻辑记忆”的能力。
科学思想:通过对金属活动性顺序和原子结构的理解,进行“结构决定性质与制法”的辩证唯物主义教育。
科学方法:通过问题的分析、讨论,引导学生掌握实践归纳、总结、探究式学习方法,逐步形成学习方法的新模式。
重点、难点
重点:金属单质的性质:金属活动性顺序的理解和应用。
难点:金属活动性顺序的理解和应用。
教学过程设计
教师活动
【板书】一、金属元素在周期表中的位置和原子结构特征

【板书】
①原子最外层电子:一般≤3个。
②价电子:主族――最外层电子;
副族――最外层+次外层电子。
③半径:
同一周期原子r金属>r非金属;
同一元素的原子和阳离子r原子>r阳离子
【板书】二、金属的晶体结构和物理性质
1.金属晶体
【讲述】金属晶体是由金属阳离子通过自由电子的强烈相互作用(即金属键)形成的晶体。这一结构特征决定了金属具有的通性。
回忆笔记:

【投影】
例题1 下列说法正确吗?为什么?
(1)含有金属阳离子的晶体一定含有阴离子。
(2)在离子晶体中既有阴离子,又有金属阳离子。
(3)离子晶体的化合物其熔点一定高于金属晶体。
引导学生思考、回答。
回答:(1)不正确。在金属晶体内就不存在阴离子。
(2)不正确。由铵根离子形成的离子晶体所含的阳离子不是金属阳离子。
(3)不正确。不同金属晶体熔点高低有的相差较大,如钨的熔点3410℃,而离子晶体的熔点一般在800℃左右。
【板书】
2.金属的物理性质
【讲述】金属都具有金属光泽、良好的导电、导热性和延展性。而密度、颜色、硬度、熔点等,不同金属之间存在一定的差别。
【投影】
例题2 判断、填空题:
(1)金属可分为重金属和轻金属,其中密度大于______的叫做重金属,如(举5种)_______。
(2)金属又可分为黑色金属和有色金属,其中Fe、Cr、Mn常称为______。
(3)在金属中,熔点最低的是______,硬度最大的是______。
引导学生思考、回答。
回答:(1)4.5g?cm-3,Cu、Hg、Ag、Pb、Ba
(2)黑色金属
(3)Hg、Cr
【讲述】金属原子易失去价电子成为阳离子,因而表现出较强的还原性。由于不同的金属原子结构、原子半径的不同,表现的还原性也有强弱不同。
【提问】请写出金属活动性顺序,并按它们的活动性顺序把有关反应的难易条件总结出来。
(指导学生讨论回答,并填表整理)
讨论回答(并列表投影展示)
金属活动性顺序:
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb(H)、Cu、Hg、Ag、Pt、Au
金属活动性(还原性):由强→弱
与O2:
与Cl2:
与水:
与酸:
与盐:
【投影】下图表示物质之间的相互转化关系:
【板书】三、金属的化学性质
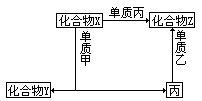
(1)若单质甲为金属,单质乙为非金属,指出它们的物质名称,并写出有关反应的化学方程式。
(2)若单质甲为非金属,单质乙为金属,指出它们的物质名称,并写出有关反应的化学方程式。
分析、讨论:
①X+甲→Y+丙,是置换反应。
②X与Z都是含Z、丙两种元素的化合物,则:X+丙→Z,为相同元素的不同价态的转化,可以考虑下列化合物转化的有:
CO2
 CO;
CO;
FeBr2
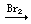 FeBr3; FeCl2
FeBr3; FeCl2 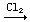 FeCl3;
FeCl3;
FeCl3
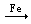 FeCl2; SO2
FeCl2; SO2  SO3;
SO3;
NO
 NO2等。
NO2等。
③若甲为金属,乙为非金属,能形成X与甲置换关系的可能有:

由于单质丙的不一致性,后者可以删去,答案只有前者。
④若甲为非金属,乙为金属,能形成X与甲置换关系的只有:
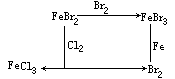
答案:(1)X:二氧化碳;Z:一氧化碳;Y:氧化镁
甲:镁;乙:氧气;丙:碳(化学方程式从略)。
(2)X:溴化铁;Y:氯化亚铁;Z:溴化铁;
甲:氯气;乙:铁;丙:溴。(化学方程式从略)
【投影】有 A、B、C、D、E五种金属。已知:①E的氧化产物比D的氧化产物氧化能力强;②A投入E的盐溶液中可得E单质;③在以A、D为极板形成的原电池中,D极上发生还原反应;④电解含有A、B、C、E离子的盐溶液时,B离子最先在电极上放电,其次是
E离子,而A、C离子则不能在电极上放电;⑤C的碳酸盐的溶解度大于它的酸式碳酸盐。推出五种金属的活动顺序是______。
判断金属活动性强弱顺序,也就是判断出金属在反应中失去电子的难易。可以根据金属活动性顺序和金属元素在周期表中位置结合试题进行分析、判断。
由①:氧化性E离子>D离子,说明金属性D>E。
由②:A能从盐溶液置换出E,说明金属性A>E。
由③:根据原电池工作原理,活泼金属为负极,发生氧化反应;不活泼金属为正极,发生还原反应,说明A>D。
由④:根据金属离子在溶液中放电顺序一般恰好与金属活动性顺序相反,说明金属性强弱A(或C)>E>B。
由⑤:只有碱金属元素才具有碳酸盐的溶解度大于相应酸式碳酸盐的溶解度。
总结分析,金属的活动性顺序为:C>A>D>E>B。
【答案】C>A>D>E>B。
【小结】本节只对金属单质化学性质规律进行了总结,不同的金属特性,将在以后的课中复习。
【板书】四、金属的冶炼
【提问】什么是金属的冶炼?其本质上是怎样的一个过程?
引导学生分析,回答,并进行笔记整理(见右侧内容)。
原理:将金属化合物或矿石通过还原反应的方法使金属阳离子还原成金属单质的过程。
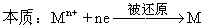
【投影】设计化学方法怎样实现Ag+→Ag。
要求写出各方案的原理,并写相应反应的离子方程式。
学生分析、讨论:
方案A:置换法。用铁置换出银:
2Ag++Fe=Fe2++2Ag↓
方案B:银氨溶液还原法。先使Ag+转化成银氨溶液,然后用葡萄糖溶液去还原:
2Ag++NH3?H2O=AgOH↓+NH4+
AgOH+2NH3?H2O=Ag(NH2)2++OH-+2H2O
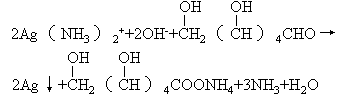
方案C:电解法:粗Ag为阳极,精Ag为阴极,NO3-溶液为电解液。
4AgNO3+2H2O
 4Ag↓+O2↑+4HNO3
4Ag↓+O2↑+4HNO3
【提问】在溶液中能实现Mg2+→Mg;Al3+→Al和Na+、Na吗?为什么?
学生:Na+、Mg2+、Al3+的得电子能力比溶液中的H+强,所以很难被还原成金属。
【讲解】
由此可以看出,随着不同金属的阳离子的氧化能力不同,主要有:电解法、还原剂法、加热法等,我们可以根据金属活动顺序把金属冶炼的方法规律总结如下:
学生思考、记笔记:
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb(H)Cu、Hg、Ag、Pt、Au、
熔融电解法 高温还原剂法 加热法 溶液电解法
金属阳离子:得电子(氧化性):弱→强
【投影――内容见右】
【提问】请同学通过Na、Al、Fe、Hg的生成冶炼的方法,写出化学方程式。
学生回答:
①Na和Al用熔融电解法冶炼:
2NaCl
 2Na+Cl2↑
2Na+Cl2↑
2Al2O3
 4Al+3O2↑
4Al+3O2↑
②Fe用高温还原剂法:
Fe2O3+3CO
 2Fe+3CO2↑
2Fe+3CO2↑
③Hg用加热法或溶液电解法:
2HgO
 2Hg+O2↑
2Hg+O2↑
2Hg(NO3)2+2H2O
 2Hg↓+O2↑+4HNO3
2Hg↓+O2↑+4HNO3
精选题
一、选择题
1.下列质量相同的各组金属混合物,分别与足量的盐酸反应,在相同状况下产生H2的体积也相同。其中含铝的质量最少的金属混合物是
( )
A.Fe和Al
B.Zn和Al
C.Mg和Al
D.Na和Al
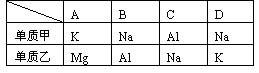
2.下表中的各组元素的单质,将0.02 mol甲放入1L 0.01 mol? L-1的盐酸中,完全反应后过滤,再往溶液中(假设无损耗)加入0.01 mol乙,整个过程中放出氢气的量最多的是 ( )
3.下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是
( )
A.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多
B.同价态的阳离子,甲比乙的氧化性强
C.甲能跟稀硫酸反应放出氢气,而乙则不能
D.将甲、乙作电极组成原电池时,甲溶解了,乙放出H2
4.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:①a、C都能跟稀硫酸反应放出气体;②b跟d的硝酸盐溶液反应,会有单质d析出;③C跟强碱溶液反应放出气体;④c、e在冷浓硝酸中发生钝化。由此可判断a、b、c、d、e依次为
( )
A.Fe、Cu、Al、Ag、Mg
B.Al、Cu、Mg、Ag、Fe
C.Mg、Cu、Al、Ag、Fe
D.Mg、Ag、Al、Cu、Fe
5.某单质X能从盐的溶液中置换出单质Y。由此可知 ( )
A.当X、Y都是金属时,X一定比Y活泼
B.当X、Y都是非金属时,Y一定比X活泼
C.当X是金属时,Y可能是金属,也可能是非金属
D.当X是非金属时,Y可能是金属,也可能是非金属
6.相等物质的量的短周期金属元素单质A和B,分别加入足量的酸,其中A中加入的是盐酸,B中加入的是稀硫酸,二者完全反应后生成的H2体积分别为VA和VB(同温、同压下),并且VA≠VB。若要确定反应生成物中A和B的阳离子电荷数,至少还需要给出的数据有
( )
A.VA和VB的比值(即VA/VB)
B.VA的值或VB的值
C.A和B的摩尔质量
D.盐酸和稀硫酸物质的量浓度
7.14.0g的铜、银金属混合粉末,跟足量的某浓度的硝酸反应,将放出的气体与1.12L标准状况下的氧气混合,通过水中恰好完全被吸收。则原金属混合粉末中铜的质量分数为 ( )
A.68.86% B.45.71%
C.22.86% D.11.43%
8.将8.4g铁粉和3.2g硫粉均匀混合加热至红热时,停止加热后使反应进行完全,冷却后,向所得固体加入足量的盐酸,在标准状况下得到的气体体积是 ( )
A.1.12L B.2.24L
C.3.36L D.4.48L
9.相等物质的量的钠、镁、铝分别与相等质量且过量的稀硫酸反应,反应完全后三种溶液的质量(用m金属表示)大小关系为 ( )
A.mNa>mMg>mAl
B.mNa=mMg=mAl
C.mNa=mMg<mAl
D.mNa<mMg<mAl
10.铊(Tl)是硼族元素,是超导体材料的组成元素之一,下列关于铊的叙述可能不正确的是 ( )
①是易导电的银白色金属;②反应后能生成+3价的化合物;③Tl(OH)3是两性氢氧化物;④Tl3+的氧化能力比Al3+氧化能力强;⑤金属铊能跟稀HNO3反应生成硝酸盐。
A.①、② B.②、③
C.④、⑤ D.③、④
二、非选择题
11.如果1 mol金属投入含1 mol酸的溶液中产生1 mol H2,下列哪种情况是可能的____。
①一价金属和二元酸 ②二价金属和二元酸
③三价金属和二元酸 ④三价金属和一元酸
⑤二价金属和三元酸 ⑥一价金属和一元酸
12.用钠、镁、铝分别与盐酸反应,填写下面几种情况的空白。
(1)称取相同质量的钠、镁、铝,然后再分别与足量的盐酸反应,产生的氢气在通常条件下的体积比为______________。
(2)取相同物质的量的钠、镁、铝,后再分别与足量的盐酸反应,产生的氢气的质量比为________________________。
(3)如果要制取相同体积的氢气(同温、同压下),与足量盐酸分别反应时所消耗的钠、镁、铝的质量比为_____________;物质的量之比为__________。
13.X、Y、Z是主族元素的单质,U、V的化合物。它们会有如下反应(式中的反应系数和条件均已略去):
①X+U→V+Y ②X+Z→V ③Y+Z→U
(1)若X、Y的组成元素不是同一族,请写出符合①式的3个不同的化学方程式,并要求3个式子中的3种X和3种Y,分别由不同族的元素组成。
_____________________________________________。
(2)今有某化合物W,它跟化合物U或CO2反应,都能生成单质Y。符合题设的3个反应式关系的单质X是______,单质Y是______,单质Z是______,化合物W为______。
14.在标准状况下进行下列实验,甲、乙、丙各取30.0mL同浓度的盐酸,加入同一镁、铝合金粉末产生气体,有关数据列表如下:

(1)盐酸的物质的量浓度为______mol?L-1,在表中可作为计算依据的是(填写实验序号,要求全部写出):___________________________________。
(2)根据实验序号______中的数据,可计算出镁、铝合金中镁和铝的物质的量之比为___________________。
15.11.5g铝、铜、镁合金溶于足量盐酸中,直到反应无气体放出,收集到的气体在标准状况下体积为5.6L。将反应的不溶物溶于足量稀硝酸中时,被还原的HNO3的质量为4.2g。试计算合金中各金属成分的质量分数。
答 案
一、选择题
1.C 2.B 3.C、D 4.C 5.A、C
6.A 7.C 8.C 9.C 10.D
二、非选择题
11.②③⑤
12.(1)23∶12∶9
(2)1∶2∶3
(3)23∶12∶9 6∶3∶2
13.(1)2Al+6HCl=2AlCl3+3H2↑
2Mg+CO2=2MgO+C
2F2+2H2O=4HF+O2↑
(2)F2 O2 H2 Na2O2
14.(1)1 mol?L-1 乙、丙
(2)甲1∶1
15.Al:23.48%;Cu:55.65%;Mg:20.87%