郑州四中2008 --2009学年上期高一年级期中考试
化学试卷 命题人 李广印
说明:1 本试卷分为第Ⅰ、Ⅱ卷两部分 请将第Ⅰ卷选择题的答案填入题后答案栏内,
2 考试时间60分钟,满分100分。
3 可能用到的原子量Na:23;C:12;O:16;S:32;H:1;Cl:35.5;
第Ⅰ卷
一、选择题(每小题4分,共56分。每小题只有一个正确答案)?
1.下列关于钠物理性质的叙述正确的是 ( )
①银白色的金属 ②质软可用小刀切
③熔点低于
A. ①②④ B.①②③④ C.①③④ D.①②③④⑤
2.金属钠分别与下列溶液反应时,既有气体,又有沉淀的是 ( )
A.硫酸铵 B.碳酸氢钠 C.氯化钡溶液 D.硫酸铜溶液
3.将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是( )
A.H2SO4 B.氯水 C.ZnSO4 D.CuCl2
4.0.1mol某元素的单质直接与Cl2反应后,质量增加
A.Na B.Al C.Fe D.Cu
5.检验某溶液中是否含有Cl-,最好的操作是( )
A.取样,滴加AgNO3溶液,看是否有白色沉淀
B.取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成
C.取样,先加稀HNO3酸化,再加入AgNO3溶液,看是否有白色沉淀生成
D.取样,加少量AgNO3溶液,有白色沉淀,再加稀HCl,看白色沉淀是否消失
6.下列叙述正确的是( )
A.标准状况下,1mol任何物质的体积约为
B.1mol气体的体积约为
C.1mol氖气和1mol氧气体积相同。
D.标准状况下,1mol氧气和氮气混合气(任意比)的体积约为
7 设NA表示阿伏加德罗常数,下列说法不正确的是 ( )
A.142gCl2 中含分子数为2NA
B.
C.
D. 58.5gNaCl中所含离子数目为NA
8. 下列离子方程式正确的是( )
A.碳酸钡溶于稀盐酸:CO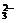 +2H+====CO2↑+H2O
+2H+====CO2↑+H2O
B.铝和稀硫酸反应:Al+2H+====Al3++H2↑
C.铜跟硝酸银溶液反应:Cu+Ag+====Cu2++Ag
D.氯化镁溶液跟NaOH溶液反应:Mg2++2OH-====Mg(OH)2↓
9 下列物质中,属于强电解质的是( )
A.CH3COOH B.Fe(OH)
10.下列各组离子在溶液中可以大量共存的是( )
A.H+、SO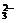 、CO
、CO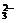 、SO
、SO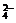 B.Ba2+、Cl-、NO
B.Ba2+、Cl-、NO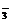 、CO
、CO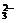
C.Mg2+、H+、SO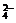 、Cl- D.Mg2+、OH-、CO
、Cl- D.Mg2+、OH-、CO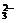 、H+
、H+
11.下列说法中正确的是( )
A.有单质生成的反应一定是氧化还原反应
B.氧化还原反应的实质是化合价的变化
C.还原剂就是反应中被氧化的物质
D.氧化剂是所含元素化合价升高的物质
12 、物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,体积比为1∶10∶100。三种溶液中Cl-的物质的量浓度之比为( )
A.1∶1∶1 B.1∶2∶3 C.1∶10∶100 D.1∶100
13.下列关天胶体的叙述不正确的是( )
A.布朗运动是胶体粒子特有的运动方式,可以据此把胶体和溶液、悬浊液、乳浊液区别开来
B.光线透过胶体时,胶体发生丁达尔现象
C.用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
14 .在标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1 L水中,所得溶液密为d g?mL-1,则此溶液的物质的量浓度为( )
A.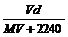 ? B.
? B.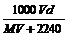 C.
C.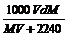 ? D.
? D.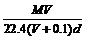

 第Ⅱ卷
第Ⅱ卷
1
2
3
4
5
6
7
8
9
10
11
12
13
14
二、填空题
15.(4分)按要求书写方程式:
(1)实验室用NaOH溶液吸收Cl2的化学方程式
(2)漂白粉在空气中变质的化学方程式
16.(8分)硫酸亚铁放置时间长了往往变棕黄色,这是因为_________________________
____________________,检验硫酸亚铁是否被氧化,应将硫酸亚铁溶于水,加入________________,根据_________________________可知已被氧化。如果要使部分氧化的硫酸亚铁[其中含少量的Fe(OH)3]恢复原状,应将其溶解于水,加入 _______________和 _______________ (填写化学式)
17(11分)某银白色固体A在空气中点燃,火焰呈黄色,并生成淡黄色固体B;将A在空气中露置,最后变成白色固体C。将A、B投入水中都生成D;B与D分别与二氧化碳反应,都能生成C。则A是____________;B是__________;C是_________;D是______________。B与H2O反应的离子方程式为____________________,B与CO2反应的化学方程式为_______________________,D与二氧化碳反应的离子方程式为___________________________
三 实验题
18、(8分)欲配制
500mL, 0.2mol/L的碳酸钠溶液回答下列问题:
(1)通过计算,应用托盘天平称取______________g碳酸钠;
(2)称取固体碳酸钠的操作顺序为(填写序号)________________________;
A、调整天平的零点 B、游码归零 C、向小烧杯中加碳酸钠
D、称量空烧杯
E、向右盘加砝码,并移动游码到所需位置 F、将砝码归盒
G、记录称量结果
(3)若砝码和药品的位置放反了(假使称量时未使用烧杯),天平平衡时称量碳酸钠的质 量是 _____________ g;
(4)下列操作使所配溶液浓度偏高的是_________________________ 。
Ⅰ、若称取28.6g
Na2CO3?10H2O进行配制 Ⅱ、称量时选用了生锈的砝码
Ⅲ、往容量瓶转移溶液时有少量的液体溅出 Ⅳ、碳酸钠中有不溶性杂质
Ⅴ、未洗涤溶解碳酸钠的烧杯
Ⅵ、定容时仰视刻度线
Ⅶ、小烧杯洗净未干燥即用来称量
Ⅷ、容量瓶未干燥即用来配制溶液
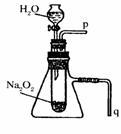 19(6分)有一演示实验:用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
19(6分)有一演示实验:用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由实验现象所得出的有关Na2O2和H2O反应的结论是:a.有氧气生成;
b. 。。
(2)某研究性学习小组拟用右图中的装置进行实验,以证明上述结论。
①用以验证结论a的实验方法是
②用以验证结论b的实验方法及现象是 。
四 计算题
20(7分)在反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中,
MnCl2+Cl2↑+2H2O中,
1参加反应的HCl与作为还原剂的HCl的分子个数比为_______________
2当被氧化的HCl为73克时,生成标况下氯气为多少升? ( 写出计算过程)
|