江苏省武进区四校联考08-09学年高三第一学期
期中考试化学试卷
命题单位:湟里高级中学 出卷人:李建军 审核人:谈东平
本卷可能用到的相对原子质量:Ca:
S:32 Na:23 H:1
考生注意:第Ⅰ、II卷所有试题答案均写在答卷纸上,否则无效。
第Ⅰ卷(选择题)
一、单项选择题:(本题包括8小题,每小题3分,共24分。每小题只有一个答案符合题意)
1、宇航员在升空、返回或遇到紧急情况时,必须穿上10公斤重的舱内航天服,神六宇航员所穿舱内航天服是我国科学家近年来研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,下列相关叙述错误的是
A.它耐高温,抗氧化 B.它比钢铁轻、硬,但质地较脆
C.它没有固定熔点 D.它是一种新型无机非金属材料
2、分析推理是化学学习方法之一。下列实验推理中,正确的是
A.金属的冶炼方法与金属的活泼性有很大的关系,所以银和汞可以用热分解的方法冶炼
B.某雨水的pH小于5.6,说明雨水中一定溶解了SO2
C.糖尿病人应少吃含糖的食品,某八宝粥中注明未加糖,所以糖尿病人可以放心食用
D.将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡,说明镁比铝活泼
3、用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.100mL 1mol/L FeCl3溶液中含阳离子数为0.1NA
B.常温常压下1 mol NO2气体与水反应生成NA个NO3-离子
C.
D.80mL 10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA
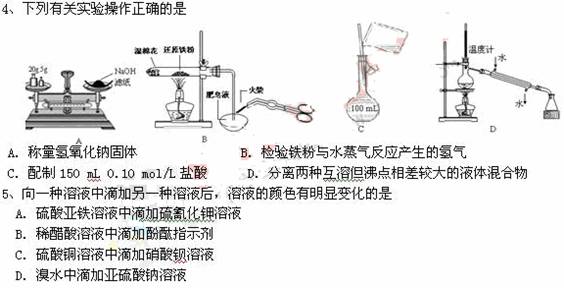
6、《青花瓷》中所描绘的“屏层鸟绘的牡丹一如你梳妆” 、“色白花青的景已跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜,近年来科学家才得大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是
A. 可用氧化物形式表示为BaO?CuO?2SiO2 B.性质稳定,不易脱色
C. 易溶解于强酸和强碱 D.x等于6
7、中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是
A.用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性的强弱
B.用沸点数据推测将一些液体混合物用分馏的方法分离开来的可能性
C.用反应热数据的大小判断不同反应的反应速率的快慢
D.用反应物、产物中键能数据可判断对应反应的热效应
8、某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理的论述中正确的是
A.镁粉只直接与溴水中的溴反应
B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到
D.镁粉在水的催化下与溴发生反应
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9、两种微粒的质子数和电子数都相等,它们不可能是
A.一种阳离子和一种阴离子 B.一种原子和一种分子
C. 一种单质分子和一种化合物分子 D. 一种分子和一种离子
10、右表为元素周期表短周期的一部分。下列有关A、B、C、D、E五种元素的叙述中,不正确的是
A
B
C
D
E
A.A与B形成的阴离子可能有:AB32-、A2B42-
11、下列离子方程式正确的是
A.过氧化钠和水反应:2O2- 2+2H2O=4OH-+O2↑
B.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-===2I2+2H2O
C.足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl-
D.碳酸氢镁溶液中加入足量的澄清石灰水:
Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
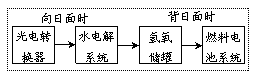 12、右图是某空间站能量转化系统的局部
12、右图是某空间站能量转化系统的局部
示意图,其中燃料电池采用KOH为电解液,
下列有关说法中不正确的是
A.该能量转化系统中的水也是可以循环的
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阴极反应:O2+2H2O+4e-=4OH-
D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O
13、某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br- 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①pH试纸检验,溶液的pH>7。②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液。④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤。⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。则关于原溶液的判断中不正确的是
A.肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32-
B.肯定存在的离子是Na+、K+、SO32-、Br- 、Cl-
C.无法确定原溶液中是否存在Cl-
D.若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响。
14.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL
4mol/L的稀硝酸,恰好使混合物完全溶解,放出
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
第II卷(非选择题)
三、本题共2题(18分)
15、(6分)
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的离子方程式:
。
(2)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H+ +Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子数是 。(设阿伏加德罗常数为NA)
(3)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3?3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是 。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
16、(12分) 甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
(1)甲组:沉淀分析法
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量。确定CaCl2溶液是否过量的方法是______________________________________________,洗涤沉淀并判断沉淀是否洗净的操作是___________________________________________________。
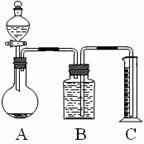 (2)乙组:气体分析法把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是_________________,选用该溶液后实验结果还是不准确,原因是______________________________。
(2)乙组:气体分析法把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是_________________,选用该溶液后实验结果还是不准确,原因是______________________________。
(3)请你设计一个与甲、乙两组操作不同的实验方案,测定混合物
中Na2CO3的含量。
方法:__________________________________。
用到的主要试剂:_____________________________(至少2种)。
用到的玻璃仪器:___________________________(至少2件)。
四、本题共2题(24分)
17、(12分)下图表示各物质之间的转化关系。
已知:常温下D、E、F、I、J为气体;C的焰色反应为黄色;M为有颜色的固体。
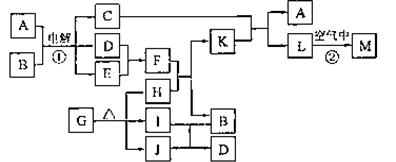
(1)写出:A的电子式 ,J的结构式 ,M的化学式 。
(2)基于反应①原理的化学工业称为 ,写出该反应的化学方程式 。
(3)写出K和E反应的离子方程式 。
写出F溶液和H反应的离子方程式 。
(4)已知由G分解得到的H、I、J三者的物质的量相等,则G的化学式为 。
18、(12分) (1) 水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。水分子在特定条件下容易得到一个H+,形成水合氢离子
(H3O+)。下列对上述过程的描述不合理的是 (填写序号)
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(2) 随着人类对水的研究的不断深入,水的应用也越来越广泛。研究人员最近发现,在一定的实验条件下,给水施加一个弱电场,在
A.代替干冰 B.防止冰川熔化
C.在室温下制作冰雕 D.建室温溜冰场
(3)写出与H2O分子互为等电子体的微粒 ;将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
(4)火星探测车在火星大气中检测到了气体A。资料显示,A分子是三原子分子,其相对分子质量为60,在地球环境下A易分解。粉未状的KSCN与浓硫酸在一定条件下可得到气体A和二种硫酸氢盐,,生成物的物质的量之比是1∶1∶1。则气体A的结构式是 。
(5)新型离子化合物[HC60]+[CB11H60Cl60]-是一种功能材料。它可以用超酸H(CB11H60Cl60)和C60反应,使C60得到质子来制取。该反应类型跟中学课本中的一个化学反应类似,课本中的这个反应是(写一个化学方程式) 。
五、本题共2题(20分)
19、(10分)A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液。A、B能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和l:1。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是 ,
(2)C和D的离子中,半径较小的是 (填离子符号)。
(3)实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多,其原因是 。
(4)C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用O表示)位于正方体的棱的中点和正方体内部;阴离子EC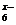 (用●表示)位于该正方体的顶点和面心,该化合物的化学式是
。
(用●表示)位于该正方体的顶点和面心,该化合物的化学式是
。
20、(10分) 在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g)  a Z(g) + W(g) △H = -Q kJ?mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ?mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是 (填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为 。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?其理由是 。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr B.a molZ、1mol W
C.1 molX、0.5mol Y、
(5) X的转化率α= (用含Q、Q1的代数式表示)。
六、计算题(10分)
21、将
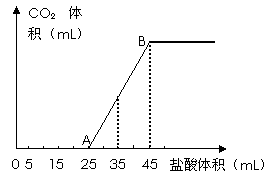 |
(1)写出OA段所发生反应的离子方程式____ ____________________。
(2)当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
(3)计算原混合物中NaOH的质量。
(其中(3)写出必要的计算过程)
 五、19、(10分)(1)
(2分)
五、19、(10分)(1)
(2分)
(2)Na+ (2分)
(3)由于HF中含有以氢键相结合的聚合氟化氢分子(HF)n (3分),(其它合理答案参考给分)
(4)Na3AlF6 (3分)
20、(10分) (1) 减小 (2分) (2) 1 (2分)
(3) 正确(1分) 2 molX和1 molY不可能完全反应 (1分)
(4) A (2分,有错不给分)
(5)  (2分)
(2分)
六、21、(10分)(1)H+ + OH― = H2O, CO32― + H+ = HCO3― (4分)
(2)224mL(2分)
(3)设碳酸钠、碳酸氢钠和氢氧化钠的物质的量分别为x、y、z,则
 x + y = 1mol/L×(0.045-0.025)L
x + y = 1mol/L×(0.045-0.025)L
z - y = 1mol/L×[0.025-(0.045-0.025)]L
x=0.01mol,y=0.01mol,z=0.015mol
所以,NaOH的质量为:0.015mol
*
