江苏省盐城市重点中学高中2009届第一协作片联考
化学试卷
命题人:东台市安丰中学 王如玉
本试卷可能用到的原子量H:1 O:16 C:12 N:14 Cl:35.5 K:39 Br:80 Mn:55 Na:23
第一卷(选择题 共48分)
一、单项选择题(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
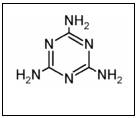 1.据凤凰网2008年9月11号报道:近期甘肃等地报告多例婴幼儿泌尿系统结石病例,调查表明与患儿食用三鹿牌婴幼儿配方奶粉含有的三聚氰胺有关,已知三聚氰胺为白色晶体,将它用作食品添加剂可提高
1.据凤凰网2008年9月11号报道:近期甘肃等地报告多例婴幼儿泌尿系统结石病例,调查表明与患儿食用三鹿牌婴幼儿配方奶粉含有的三聚氰胺有关,已知三聚氰胺为白色晶体,将它用作食品添加剂可提高
食品中蛋白质的检测值,俗称“蛋白精”,结构简式为 ,
下面有关三聚氰胺说法中不正确的是 ( )
A.它分子式为C3H6N6 B.它在一定条件可能会与氢气发生加成反应
C.它能与硝酸发生环上的取代反应 D.它呈一定的弱碱性
2.奥运会火炬可用丙烷或丁烷作燃料.已知丙烷的沸点为-
A.奥运火炬中燃料燃烧主要是将化学能转变为热能和光能
B.烷烃的沸点和燃烧热都随碳原子数增加而成比例递增
C.异丁烷的沸点肯定低于-
D.正己烷在常温常压下肯定不是气体
现象或反应
原理解释
A.
铝箔在酒精灯火焰上加热熔化但不滴落
铝箔对熔化的铝有较强的吸附作用
B.
合成氨反应需在高温条件下进行
该反应为吸热反应
C.
镀层破损后,镀锡铁比镀锌铁易腐蚀
锡比锌活泼
D.
2CO=C+O2在任何条件下均不能自发进行
该反应△H>0,△S<0
3.下列现象或反应的原理解释正确的是
4.对于密闭容器中的可逆反应:mX (g) + nY(s)
 pZ
(g);ΔH<0,达化学平衡后,改变条件,下列表述不正确的是 ( )
pZ
(g);ΔH<0,达化学平衡后,改变条件,下列表述不正确的是 ( )
A.增大压强,化学平衡不一定发生移动
B.通入氦气,化学平衡不一定发生移动
C.增加X或Y的物质的量,化学平衡一定发生移动
D.2N5= 5N2是化学变化
5、某烃结构式用键线式表示为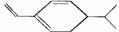 ,该烃与Br2加成时(物质的量之比为1┱1,所得产物有
,该烃与Br2加成时(物质的量之比为1┱1,所得产物有
A.3种 B.4种 C.5种 D.6种
6.将NaCl和NaBr的混和物mg溶于足量的水配成500mL的溶液A,再向其中通入足量的氯气,充分反应后蒸发至干,得干燥晶体(m-2)g,则A溶液中Na+、Br-、Cl-的物质的量浓度之比不可能为
A.3┱2┱1 B.3┱1┱
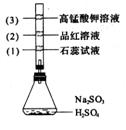
7.如图所示,锥形瓶中加入亚硫酸钠固体和1┱l的硫酸,玻璃管内装入分别滴有不同
溶液的棉球,反应一段时间后,对图中指定部位颜色描述正确的是
(1)
(2)
(3)
A
褪色
褪色
变红
B
变红
变红
褪色
C
变红
褪色
褪色
D
褪色
变红
褪色
8.某有机物分子中含有强还原性基团,将其与苛性钠溶液共煮后,可得到两种有机物,其中一种仍有强还原性,则该有机物可能是
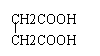
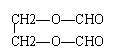
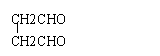
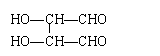 A. B. C.
D.
A. B. C.
D.
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符)
9.科学的假设与猜想是科学探究的先导和价值所在。在下列假设(猜想)引导下的探究肯定没有意义的选项是
A.探究SO2和Na2O2反应可能有Na2SO4生成
B.探究Na与水的反应可能有O2生成
C.探究浓硫酸与铜在一定条件下反应产生的黑色物质可能是Cu(OH)2
D.探究向滴有酚酞试液的NaOH溶液中通以Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致
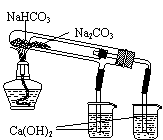
 10.用下列装置能达到有关实验目的的是
10.用下列装置能达到有关实验目的的是
 |
甲 乙 丙 丁
A.用甲图装置电解精炼铝 B.用乙图装置制备Fe(OH)2
C.用丙图装置可制得金属锰 D.用丁图装置验证NaHCO3和Na2CO3的
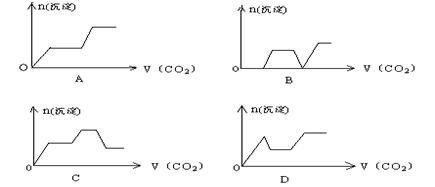
11.将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为:
12.化学反应N2+3H2 = 2NH3的能量变化如题图所示,该反应的热化学方程式是
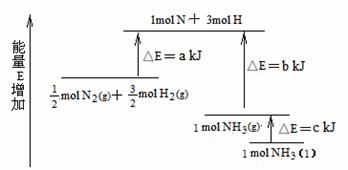
A.N2(g)+3H2(g) = 2NH3(g) ;ㄓH = 2(b―a)kJ?mol-1
B.N2(g)+3H2(g) = 2NH3(l);ㄓH = 2(a―b―c)kJ?mol-1
C.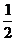 N2(g)+
N2(g)+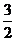 H2(g) = NH3(l) ;ㄓH = (b+c―a)kJ?mol-1
H2(g) = NH3(l) ;ㄓH = (b+c―a)kJ?mol-1
D.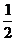 N2(g)+
N2(g)+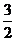 H2(g) =NH3(g) ;ㄓH = (a+b)kJ?mol-1
H2(g) =NH3(g) ;ㄓH = (a+b)kJ?mol-1
13.常温下,0.1mol/L Na2CO3溶液中各微粒浓度关系正确的是
A.c(Na+)>c(CO32-)>c(HCO3-)>c(H2CO3)
B.c(Na+)>c(CO32-)>c(H+)>c(OH―)
C.c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
D. c(Na+)=2{c(CO32-)+c(HCO3-)+c(H2CO3)}
14.最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是
A.该电池Zn为负极,ZnO为正极,MnO2为催化剂
B.该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH-
C.导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
D.电池工作时水分子和OH-都能通过薄层纸片
第二卷(非选择题 共72分)
三、(本题包括2小题,共16分)
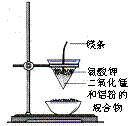
15.(8分)某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究。
 步骤1:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、胶塞等装配如图所示的装置。另准备一只胶塞,其中有一根铜丝穿过,铜丝末端固定一根镁条备用。
步骤1:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、胶塞等装配如图所示的装置。另准备一只胶塞,其中有一根铜丝穿过,铜丝末端固定一根镁条备用。
步骤2:引燃燃烧匙中的试剂,塞好瓶塞。燃烧结束后,调节广口瓶内外液面相平。
步骤3:点燃镁条,更换胶塞,镁条继续燃烧,反应结束后,广口瓶内水面上升。
步骤4:取蒸发皿中得到的固体,加盐酸溶解。向溶液中加入过量氢氧化钠溶液,有白色沉淀生成,同时得到一种能使湿润红色石蕊试纸变蓝的气体。
⑴为除去广口瓶中的氧气,燃烧匙中应装入下列试剂中的 ▲ (填序号)。
A.炭粉 B.硫粉 C.红磷
⑵“步骤
⑶写出Mg3N2溶于足量盐酸生成两种氯化物的化学方程式: ▲ 。
⑷某同学直接将镁条在空气中点燃,并将所得白色固体进行“步骤
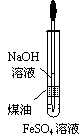
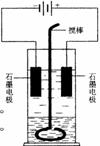 16.(8分)在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
16.(8分)在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(1)阳极上的电极反应式为______▲ _______________。
(2)原上层液体是_____________▲ ________________。
(3)原下层液体是_____________▲ ________________。
(4)要检验上层液体中含有的金属离子其方法是 ▲ 。
四、(本题包括2小题,共22分)
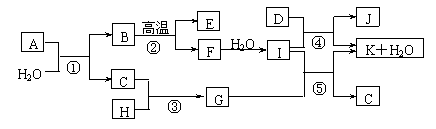 17(10分).下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于饮水消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
17(10分).下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于饮水消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
请回答下列问题:
⑴物质E的电子式是_____▲ _______;物质J的名称为 ▲ 。
⑵反应⑤的化学方程式为________▲ ___________________________________。
⑶反应③的现象为_______________________▲ ____________________。
⑷物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为______▲ __。
18(12分).有机物A在一定条件下有如下图的转换关系:
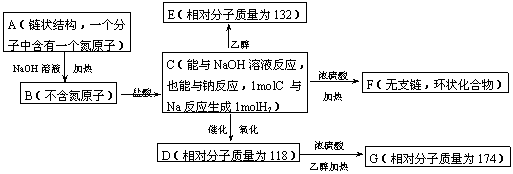 |
试回答下列问题:
(1)在A~G中属于酯类化合物的是______▲ ____________。
(2)写出A、D、F的结构简式:A:_____▲ _____D:____▲ ______ F:______▲ ______。
五、(本题包括2小题,共20分)
19.(10分)下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
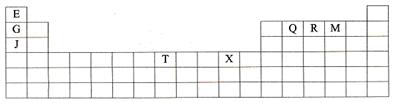
(1)T3+的核外电子排布式是: ▲
(2)Q、R、M的第一电离能由大到小的顺序是 ▲ (用元素符号表示)
(3)下列有关上述元素的说法中,正确的是: ▲ (填序号)
①G单质的熔点高于J单质,是因为G单质的金属键较强②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个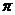 键
▲
键
▲
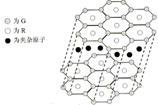
(4)加拿大天文台在太空发现了EQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键。写出其结构式:
(5)G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 ▲ (填G或R的元素符号)
 20(10分).铜及其合金是人类最早使用的金属材料。
20(10分).铜及其合金是人类最早使用的金属材料。
⑴铜原子的核外电子排布式是 ▲ 。
⑵右图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为 ▲ 。
⑶Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有 ▲ (填序号)。
A.配位键 B.金属键 C.极性共价键 D.非极性共价键 E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 ▲ 。
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 ▲ 。
_______________
六、(本题包括1小题,14分)
21.(!)(8分)工业上电解质量分数为23.4%的精制食盐水a kg,电解后残液的密度为ρ kg/L。将产生的H2、Cl2在一定条件下反应制成质量分数为36.5%的盐酸b kg,已知H2、C12的利用率均为c%。试计算(用含题中字母的代数式表示):
(1)制得氯化氢___▲ _______mol。
(2)残液中氯化钠的质量________▲ _________ Kg。
(3)残液中氢氧化钠的物质的量浓度 ▲ mol/L。
(2)(6分)0.04mol KMnO4固体,加热一段时间后,收集到amol气体,在反应后的残留固体中加入足量的浓盐酸又收集到bmol气体,设此时Mn元素全部以Mn2+存在于溶液中,则:
(1)a+b的取值范围为 ▲ ;
(2)计算若a+b=0.09mol时,残留固体的质量为多少 ▲ 克
参 考 答 案
⑴C ⑵向水槽中加水 ⑶Mg3N2+8HCl=3MgCl2+2NH4Cl
⑷氧气比氮气活泼,与镁反应生成MgO
16(每空2分,共8分) (1)2I--2e-=I2
(2)KI(或NaI等)水溶液
(3)CCl4(或CHCl3等)
(4)焰色反应
四、17.(每空2分,共10分)
⑴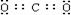 (2分) 次氯酸钙(2分)
(2分) 次氯酸钙(2分)
⑵Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O (2分)
CaCl2+2NH3↑+2H2O (2分)
⑶有白烟产生 (2分)
⑷CaCN2 (2分)
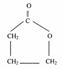 18(每空3分,共12分)(1)E F
G(2)HOCH2CH2CH2COONH4
18(每空3分,共12分)(1)E F
G(2)HOCH2CH2CH2COONH4
HOOCCH2CH2COOH
五、
19 (每空2分,共10分)(1)[Ar]3d5或1s22s22p63s23p63d5 (2分)
(2)N>O>C (2分)
(3)①③⑤(2分)
(4)H―C≡C―C≡C―C≡C―C≡C―C≡N (2分)
(5)Li (2分)
20(每空2分,共10分)① ⑴1s22s22p63s23p63d104s1 (2分)
⑵ 1:5(2分)
⑶ ①A、C (2分)
②平面正方型(2分)
③sp2 (2分)
21(14分) (1) ①10b(2分)
②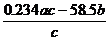 (3分)
(3分)
③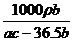 mol/L(3分)
mol/L(3分)
(2)①0.08≤a+b<0.1 (3分) ②6g(3分)