辽宁省鞍山市2009年高三毕业班第一次质量调查
理科综合
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,其中第Ⅱ卷第30~38题为选考题,其它题为必考题。第Ⅰ卷1至6页,第Ⅱ卷6至15页。考试结束后,将本试题卷和答题卡一并交回。
可能用到的相对原子质量:H-1、C-12、O-16、Na-23
第Ⅰ卷
一、选择题:本题共13小题,每小题6分,共78分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.关于稳态的实现,下列叙述有误的是
A.血液中的缓冲物质可以调节PH
B.肾脏不时地排出内环境中多余的水、尿素、无机盐等
C.将食物残渣形成粪便排出体外
D.肝脏储存的肝糖原在血糖浓度下降时分解并不断释放入血液
2.水溶性染色剂(PI),能与核酸结合而使细胞核着色,可将其应用于细胞死活的鉴别。细胞浸泡于一定浓度的PI中,仅有死亡细胞的核会被染色,活细胞则不着色,但将PI注射到细胞中,则细胞核会着色。利用PI鉴别细胞的基本原理是
A.死细胞与活细胞的核酸结构不同 B.死细胞与活细胞的核酸含量不同
C.活细胞能分解染色剂PI D.活细胞的细胞膜阻止PI的进入
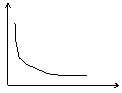 3.右图所示曲线不能表达前者随后者变化的是
3.右图所示曲线不能表达前者随后者变化的是
A.乳酸菌的无氧呼吸与氧气浓度的关系
B.正在发生质壁分离复原的细胞的吸水力与时间关系
C.囊胚期每个细胞的核内DNA数目与时间关系
D.艾滋病患者体内T细胞数量与HIV浓度的关系
4.镰刀型细胞贫血症是一种遗传病,隐性纯合子(aa)的患者不到成年就会死亡,可见这种突变基因在自然选择的压力下容易被淘汰。但是在非洲流行恶性疟疾(一种死亡率很高的疾病)的地区,带有这一突变基因的人(Aa)很多,频率也很稳定。对此现象合理解释是
A.杂合子不易感染疟疾,显性纯合子易感染疟疾
B.杂合子易感染疟疾,显性纯合子不易感染疟疾
C.杂合子不易感染疟疾,显性纯合子也不易感染疟疾
D.杂合子易感染疟疾,显性纯合子也易感染疟疾
5.科技人员在对草原鼠害进行调查时,随机选定某区域,第一次放置了100只老鼠笼,捕获68只鼠,标记后原地放回,一段时间后在相同位置放置了100只鼠笼,捕获54只鼠,其中标记的鼠有12只,下列有关说法中错误的是
A.该区域中鼠的种群密度较大,约为306只,必须积极防治
B.这种调查方法称为样方法
C.草原上鼠与牛、羊等是竞争关系,鼠害会严重影响畜牧业发展
D.如果在两次捕鼠期间发生草原大火,统计结果是不准确的
6.某种酶是由419个氨基酸组成的蛋白质。科学家利用生物技术手段将其切成5种不同长度的肽链片段,分别测定其活性。结果如图所示,请分析该酶具有活性的部分最可能是下列哪一部分?


A.第196号氨基酸到第419氨基酸 B.第1号氨基酸到第43号氨基酸
C.第44号氨基酸到第85号氨基酸 D.第197号氨基酸到第302号氨基酸
7.下列说法正确的是
A.酒精既可以杀菌、消毒,也可以作燃料
B.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
C.能发生水解反应的有机物一定是酯类物质
D.最简式相同的有机物一定互为同分异构体
8.根据下列实验现象,所得结论正确的是
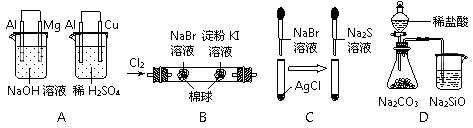

实验
实验现象
结论
A
左烧杯中镁表面有气泡,右烧杯中铜表面有气泡
活动性:Al>Mg>Cu
B
左边棉花变为橙色,右边棉花变为蓝色
氧化性:Cl2>Br2>I2
C
白色固体先变为淡黄色,后变为黑色
溶解度:AgCl>AgBr>Ag2S
D
锥形瓶中有气体产生,烧杯中液体变浑浊
非金属性:Cl>C>Si
9.在下列情况下,溶液中一定能大量共存的离子组是
A.能使pH试纸变深蓝色的溶液中:SO2-4、SO2-3、CO2-3、Na+
B.pH=l的溶液:Fe2+、SO2-4、NO-3、Cl-
C.由水电离出的c(H+)=l×l0-12 mol/L的溶液中:K+、Na+、AlO-2、ClO一
D.含有大量Al3+的溶液:Na+、NH+4、SO2-4、HCO-3
10.已知
4Al(s)+3O2(g)=2Al2O3(s),△H=-2834.9 kJ/mol;
4Al(s)+2O3(g)=2Al2O3(s),△H=-3119.1 kJ/mol。
由此得出的结论正确的是
A.O3比O2稳定,由O2变O3为吸热反应
B.O2比O3稳定,由O2变O3为放热反应
C.等质量的O2比O3能量低,由O2变O3为吸热反应
D.等质量的O2比O3能量低,由O2变O3为放热反应
11.对于达到平衡的可逆反应:A(g)+3B(g)
A.降低温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.在一定温度下,减小压强,平衡向逆反应方向移动,B的浓度增大
C.在恒温、恒容条件下,向平衡体系中加入A物质,C的体积分数增加
D.在恒温、恒压条件下,将平衡体系中各物质的物质的量均减少一半,平衡不移动
12.下列说法正确的是
A.由非金属元素组成的化合物一定是共价化合物
B.阴阳离子相互作用后形成的一定是离子化合物
C.失去电子难的原子,获得电子的能力一定强
D.电子层结构相同的不同离子,核电荷数越多,半径越小
13.将标准状况下的
A.c(HCO-3)略大于c(CO2-3) B.c(HCO-3)略小于c(CO2-3)
C.c(HCO-3)等于c(CO2-3) D.c(Na+)等于c(CO2-3)与c(HCO-3)之和
二、选择题:本题共8小题,每小题6分,共48分,在每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得6分,选对但不全的得3分,有选错的得0分。
 14.如图所示。理想变压器的原线圈ab两端接正弦交流电压,副线圈cd两端通过输电线接两只相同的灯泡L1和L2,输电线的等效电阻为R,在图示状态开关S是闭合的,当开关S断开时下列各量减小的是
14.如图所示。理想变压器的原线圈ab两端接正弦交流电压,副线圈cd两端通过输电线接两只相同的灯泡L1和L2,输电线的等效电阻为R,在图示状态开关S是闭合的,当开关S断开时下列各量减小的是
A.副线圈cd两端输出的电压
 B.通过灯泡L1的电流
B.通过灯泡L1的电流
C.副线圈等效电阻R上的电压
D.原线圈ab两端的电压
15.如图所示。在地球上的某点固定一光滑的长木板(木板长度远小于地球半径)在长木板上A点由静止释放一物体,使之开始运动,则它的速度图象最接近下列四个图像中的

 16.我国未来将建立月球基地,并在绕月轨道上建立空间站,如图所示。关闭动力的航天飞机在月球引力作用下向月球靠近并将与空间站在B处对接,已知空间站绕月轨道半径为r,周期为T,引力常量为G。下列说法中正确的是
16.我国未来将建立月球基地,并在绕月轨道上建立空间站,如图所示。关闭动力的航天飞机在月球引力作用下向月球靠近并将与空间站在B处对接,已知空间站绕月轨道半径为r,周期为T,引力常量为G。下列说法中正确的是
A.图中航天飞机正加速飞向B处
B.航天飞机在B处由椭圆轨道进入空间站轨道必须点火减速
C.据题中的条件可以计算出月球的质量
D.据题中的条件可以计算出空间站受到的月球引力的大小
17.物体做直线运动的位移时间图像如图所示。则关于该物体运动情况的下列判断正确的是
 A.OA段以及AB段均做加速运动
A.OA段以及AB段均做加速运动
B.OA段以及AB段均做减速运动
C.OA段做加速运动,AB段做减速运动
D.OA段做减速运动,AB段做加速运动
18.如图所示。直角三角形导线框abc以大小为V的速度匀速通过有清晰边界的匀强磁场区域(匀强磁场区域的宽度大于导线框的边长),则此过程中导线框中感应电流的大小随时间变化的规律为下列四个图像当中的哪一个?

 19.如图甲所示。一条电场线与OX轴重合,取O点电势为零,OX方向上各点的电势
19.如图甲所示。一条电场线与OX轴重合,取O点电势为零,OX方向上各点的电势 随x变化的情况如图乙所示。若在O点由静止释放一电子,电子仅受电场力的作用,则下列说法正确的是
随x变化的情况如图乙所示。若在O点由静止释放一电子,电子仅受电场力的作用,则下列说法正确的是
A.电子将沿OX方向运动
B.电子的电势能将增大
C.电子运动的加速度先减小后增大
D.电子运动的加速度恒定
20.水平传送带匀速运动,速度大小为V,现将一小工件放到传送带上。设工件初速为零,当它在传送带上滑动一段距离后速度达到V而与传送带保持相对静止。设工件质量为m,它与传送带间的滑动摩擦系数为μ,则在工件相对传送带滑动的过程中
A.滑动摩擦力对工件做的功为mV2/2
B.工件的机械能增量为mV2/2
C.工件相对于传送带滑动的路程大小为V2/2μg
D.传送带对工件做为零
21.如图甲所示。在空间存在一个变化的电场和一个变化的磁场,电场的方向水平向右(图甲中由B到C),电场强度的大小随时间变化的情况如图乙所示;磁感应强度方向垂直于纸面,磁感应强度大小随时间变化的情况如图丙所示。在t=1S时,从A点沿AB方向(垂直于BC)以初速度V0射出第一个粒子(不计重力),并在此之后,每隔2S有一个相同的粒子沿AB方向均以初速度V0射出,射出的粒子均能击中C点。若AB=BC=L,且粒子由A运动到C的时间均小于1S。不计空气阻力及电磁场变化带来的影响,则以下说法正确的是

A.磁场方向垂直纸面向外
B.电场强度E0和磁感应强度B0的比值E0/B0=2V0
C.第一个粒子由A运动到C所经历的时间t1=πL/2 V0
D.第二个粒子到达C点的动能等于第一个粒子到达C点的动能
第Ⅱ卷
(一)必考题(8题,共129分)
三、非选择题:包括必考题和选考题两部分。第22题~第29题为必考题,每个试题考生都必须做答。第30题~第38题为选考题,考生根据要求做答。
22.(15分)
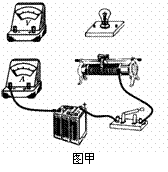
(1)(4分)如图所示,是使用游标卡尺和螺旋测微器分别测量两个工件时的情况。图中游标卡尺的读数为 mm,螺旋测微器的读数为 mm。


(2)(5分)在研究匀变速直线运动的实验中,连结在小车上的纸带通过打点计时器(使用50 Hz的低压交流电源)时,被打上许多点,若每5个点取一个计数点,并量得各计数点之间的距离为S1=2.

(3)(6分)在“描绘小灯泡的伏安特性曲线”的实验中,可供选择的实验仪器如下:
器 材
规 格
器 材
规 格
小灯泡
标有“3.8V,0.3V”字样
滑动变阻器R1
最大阻值10Ω,额定电流
电压表V
量程0―5V,内阻5kΩ
滑动变阻器R2
最大阻值1kΩ,额定电流
电流表A1
量程0―100mA,内阻4Ω
直流电源E
电动势约为6V,内阻约为0.5Ω
电流表A2
量程0―500mA,内阻0.4Ω
导线、电键等
 ①在上述器材中,滑动变阻器应选
。
①在上述器材中,滑动变阻器应选
。
②在图甲中用笔画线代替导线,把实验仪器连接成完整的实验电路。
③利用实验中得到的实验数据在I-U坐标系中,描绘出了图乙所示的小灯泡的伏安特性曲线。根据此图给出的信息,可以判断出图丙中正确的是(图中P为小灯泡功率)( )

23.(15分)滑雪是冬季一项极具刺激性的运动项目,如图甲所示,滑雪者踏着雪橇(它们的总质量为
 (1)雪橇在开始阶段做什么运动?
(1)雪橇在开始阶段做什么运动?
(2)当雪橇的速度为
(3)空气的阻力系数k与雪橇与倾斜雪面间的动摩擦因数μ。(g=
24.(17分)如图所示。XOY直角坐标系在竖直平面内,Y轴正方向竖直向上,X轴正方向水平向右。在X轴的下方区域内存在磁感应强度为B、方向水平向外的匀强磁场和竖直方向的、场强未知的匀强电场。现有一质量为m、带电量为+q的带电小球从Y轴上的P点以某一初速度沿X轴正方向水平抛出,经X轴上离坐标原点O的距离为 d的Q点进入X轴下方的磁场和电场区域,此时速度方向与X轴正方向成600角,此后该带电小球做匀速圆周运动,经坐标原点进入X轴上方的区域(提示:斜抛运动的水平分运动是匀速运动,竖直分运动是竖直上抛运动),做一种周期性的运动。试求:
d的Q点进入X轴下方的磁场和电场区域,此时速度方向与X轴正方向成600角,此后该带电小球做匀速圆周运动,经坐标原点进入X轴上方的区域(提示:斜抛运动的水平分运动是匀速运动,竖直分运动是竖直上抛运动),做一种周期性的运动。试求:
 (1)匀强电场的场强大小和方向。
(1)匀强电场的场强大小和方向。
(2)OP间的距离和带电小球的初速度。
(3)带电小球的运动周期以及在足够长的时间内带电小球在X轴方向的平均速度。
25.(14分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等特点于一体的新型多功能绿色环保水处理剂。其生产工艺如下:


根据上述工艺流程,请回答下列问题:
(1)工业所用Cl2主要来自氯碱工业,氯碱工业产生Cl2的化学方程式为
。
(2)已知Cl2与KOH溶液反应,在较低温度下主要生成KClO,在较高温度下主要生成KClO3,该生产工艺应在 (填“较低温度”或“较高温度”)下进行。
(3)该生产工艺中生成K2FeO4的离子方程式为 。
(4)在“反应液Ⅰ”中加KOH固体的目的是 。
A.与“反应液Ⅰ”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为KClO
(5)K2FeO4具有灭菌、消毒作用的主要原因是 。其灭菌、消毒后的产物具有很好的絮凝作用,根据你所学的知识推测,起絮凝作用的物质是 。
(6)从“反应液Ⅱ”中分离出K2FeO4后,会得到两种重要的化工产品,它们是
(写化学式)。
26.(15分)二氧化硫和氮氧化物是常用的化工原料,但也会给大气带来污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1)汽车尾气中主要含有CO、CO2、NO2、SO2等气体,其中 能导致酸雨的形成。目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。如:
CO(g)+NO2(g)=NO(g)+CO2(g),△H=-a kJ/mol(a>0);
2CO(g)+2NO(g)=N2(g)+2CO2(g),△H=-b kJ/mol(b>0)。
据此回答:若用标准状况下
 (2)火力发电厂产生的废气中含有SO2、N2、CO等气体,为除去SO2,常用Ca(OH)2悬浊液洗涤废气,为了废物利用,再通入空气使反应产物转化为石膏(CaSO4?2H2O)。写出有关反应的化学反应方程式
。
(2)火力发电厂产生的废气中含有SO2、N2、CO等气体,为除去SO2,常用Ca(OH)2悬浊液洗涤废气,为了废物利用,再通入空气使反应产物转化为石膏(CaSO4?2H2O)。写出有关反应的化学反应方程式
。
 (3)在硫酸工业中,需要将SO2催化氧化生成SO3:2SO2(g)+O2(g)
2SO3(g),△H=-196 kJ/mol。右图为某温度下,5 mol
SO2和7 mol O2在密闭容器中反应达到平衡时,SO2的体积分数与体系的总压强的关系。根据此图回答下列问题:
(3)在硫酸工业中,需要将SO2催化氧化生成SO3:2SO2(g)+O2(g)
2SO3(g),△H=-196 kJ/mol。右图为某温度下,5 mol
SO2和7 mol O2在密闭容器中反应达到平衡时,SO2的体积分数与体系的总压强的关系。根据此图回答下列问题:
①平衡状态由A变到B时,反应体系 (填“吸收”或“释放”)能量。
②若上述反应在
 27.(14分)某化学课外活动小组欲制取纯净的Na2CO3溶液,经过讨论,他们形成了三种实验方案,这三种实验方案的反应流程如下:
27.(14分)某化学课外活动小组欲制取纯净的Na2CO3溶液,经过讨论,他们形成了三种实验方案,这三种实验方案的反应流程如下:
 甲:NaOH溶液 Na2CO3溶液
甲:NaOH溶液 Na2CO3溶液
 乙:NaOH溶液 NaHCO3溶液
Na2CO3固体 Na2CO3溶液
乙:NaOH溶液 NaHCO3溶液
Na2CO3固体 Na2CO3溶液
丙:NaOH溶液 NaHCO3溶液 Na2CO3溶液
请回答下列问题:
(1)请指出甲、乙两方案的主要缺点:
甲: ;
乙: 。
(2)若采用丙方案制取纯Na2CO3溶液,则其操作为
。
(3)若反应②所得的NaHCO3溶液中含有Na2CO3,则用 (填写试剂的化学式)溶液可证明Na2CO3的存在,其现象为 。
(4)若反应①所得的Na2CO3固体中混有未分解的NaHCO3,某同学用澄清石灰水来测定其中NaHCO3的质量分数,则该同学能否达到实验目的? 。若能,请说明计算所需的数据;若不能,请简要说明理由。 。
28.(15分)回答下列I、II题:
I.下图是用农作物①和②两个品种分别培育出④、⑤、⑦ 三个品种的过程,A、a和B、b、D为基因,且A、a和B、b位于非同源染色体上。

(1)Ⅱ过程的原理是__________________________。
(2)Ⅲ过程使用了_________________________技术。
(3)Ⅳ→Ⅴ过程培育新品种能明显缩短育种年限的原因是_____________________________。
II.为了验证胰岛素具有降低血糖浓度的作用。请根据以下提供的实验材料和用具,以小鼠是否出现活动减少、行动迟缓甚至昏迷等低血糖症状为观察指标,设计实验步骤、预测实验结果。
材料与用具:一组正常成年小鼠、适宜浓度的葡萄糖溶液、适宜浓度的胰岛素溶液、注射器等。(要求:答题时对该组小鼠不再分组;注射剂量不作要求。)
(1)实验步骤:
(2)预测实验结果:
29.(24分)回答下列I、II题
I.2004年诺贝尔化学奖授予以色列科学家阿龙?切哈诺沃、阿夫拉姆?赫什科和美国科学家欧文?罗斯,以表彰他们发现了泛素在细胞内蛋白质降解作用,揭开了蛋白质“死亡”的重要机理。
(1)生物体内存在着两类蛋白质降解过程,一种是不需要能量的,比如发生在消化道中的初步降解,这一过程只需要______参与;另一种则需要能量,它是一种高效率、针对性很强的降解过程。消耗的能量直接来自于________产生的_________。
(2)细胞内的蛋白质处于不断地降解与更新的过程中。泛素在其蛋白质降解过程中,起到“死亡标签”的作用,即被泛素标记的蛋白质将被特异性地识别并迅速降解,发生降解过程与细胞内________(被称为“消化车间”的细胞器)有关。
(3)泛素是一个由76个氨基酸组成的多肽链,只在细胞内起作用,可见泛素是在细胞质内的________中合成的,其合成方式称为_____________。
II.为证实“二氧化碳是光合作用合成有机物必需的原料”。某同学制订了下列方案。
(1)实验目的(略) (2)实验材料和步骤(略)
(3)实验方法和步骤:
①用一适当大小的玻璃罩罩住一株生长正常的盆栽绿色植物和一杯NaOH溶液。密封不漏气;
②将上述植物及装置放在暗室中饥饿,消耗掉叶片内贮藏的有机物,暗室装有红色安全灯
③饥饿一定时间后,自暗室中取出,照光若干小时,使其充分进行光合作用;
④取一叶片,放入盛有酒精的烧杯中,水浴加热,使叶绿素溶于酒精中。
⑤将已脱绿的叶片取出,平铺在一个培养皿内,用碘溶液检测有无葡萄糖的特异颜色反应出现。
该实验方案有几项明显错误。请指出并改正。
(二)选考题:共45分。请考生从给出的4道物理题、3道化学题、2道生物题中每科任选一题作答,并用2B铅笔在答题卡上把所选题目的题号涂黑。注意所做题目的题号必须与所涂题目的题号一致,在答题卡选答区域指定位置答题。如果多做,则每学科按所做第一题计分。
30.【物理―选修2―2】(15分)

 (1)(6分)如图所示为一皮带传动装置。已知A、B、C三轮的半径之比为4 :2 :3,传动过程中皮带不打滑。则A轮边缘上的M点和C轮边缘上的N点的线速度之比为
,角速度之比为
。
(1)(6分)如图所示为一皮带传动装置。已知A、B、C三轮的半径之比为4 :2 :3,传动过程中皮带不打滑。则A轮边缘上的M点和C轮边缘上的N点的线速度之比为
,角速度之比为
。
(2)(9分)如图所示。OA为竖直墙面上的两点,在O点固定一长为L=
31.【物理―选修3―3】(15分)
(1)(6分)下列说法中不正确的是( )
A.若两分子只受它们间分子力的作用,在两分子间距离增大的过程中,分子动能一定增大
B.用N表示阿伏伽德罗常数,M表示铜的摩尔质量,ρ表示铜的密度,则一个铜原子所占空间的体积为M/ρN
C.布朗运动是液体分子对悬浮颗粒的碰撞作用不平衡造成的
D.容器中的气体对器壁的压强是由于大量气体分子频繁撞击器壁而产生的
 (2)(9分)压缩喷雾器的结构如图所示。A的总容积
(2)(9分)压缩喷雾器的结构如图所示。A的总容积
32.【物理―选修3―4】(15分)
(1)(6分)关于机械振动和机械波,下列说法正确的是( )
A.机械波与电磁波的传播速度均与波源振动频率无关,并且均能在真空中传播
B.对于在空气中传播的声波来说,由于υ=λ?f,所以频率越高,声速也越大
C.机械波和电磁波均能发生干涉和衍射现象
D.机械波可能是横波或纵波,而电磁波一定是横波
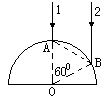 (2)(9分)半径为R的玻璃半圆柱体的横截面如图所示,圆心为O。两条平行单色红光沿截面射向圆柱面,方向与底面垂直。光线1的入射点A为圆柱面的顶点,光线2的入射点为B,∠AOB=600。已知该玻璃对红光的折射率为n=
(2)(9分)半径为R的玻璃半圆柱体的横截面如图所示,圆心为O。两条平行单色红光沿截面射向圆柱面,方向与底面垂直。光线1的入射点A为圆柱面的顶点,光线2的入射点为B,∠AOB=600。已知该玻璃对红光的折射率为n=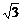 。(1)求两条光线经柱面和地面折射后的交点与O点的距离d。(2)若入射的是单色蓝光,则距离d将比上问中求得的结果大还是小?
。(1)求两条光线经柱面和地面折射后的交点与O点的距离d。(2)若入射的是单色蓝光,则距离d将比上问中求得的结果大还是小?
33.【物理―选修3―5】(15分)
(1)(6分)下列说法正确的是( )
A.放射性同位素的衰变快慢可以用人工方法控制
B.同一种物质的原子发光时,只能辐射几种不同频率的光
C.对核能的和平利用不仅能够利用重核裂变,也能利用轻核的聚变现象
D.光子射到金属表面,一定有光电子射出
 (2)(9分)如图所示。在光滑的水平面上有一带有光滑平台的、质量为M=
(2)(9分)如图所示。在光滑的水平面上有一带有光滑平台的、质量为M=
(1)物块离开平台右端P点时的对地速度大小。
(2)开始时弹簧贮存的弹性势能。
34.【化学―选修 化学与技术】(15分)
氨碱法和联合制碱法(候氏制碱法)的生产流程简要表示如下图:


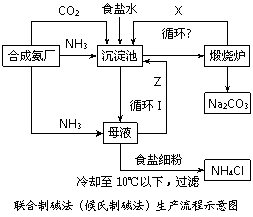

(1)沉淀池中发生反应的化学方程式为 。
(2)X是 ,Y是 (填化学式)。
(3)Z中除了溶解的氨气、食盐外,其它溶质还有 ;排出液W中的溶质除了氢氧化钙外,还有 。
(4)从理论上分析,在氨碱法生产过程中 (填“需要”或“不需要”)补充氨气。从原料到产品,氨碱法总反应过程可用化学方程式表示为 。
(5)根据联合制碱法从母液中提取氯化铵晶体的过程推测,下列结论正确是 。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气的目的是使氯化铵更多析出
c.加入食盐细粉的目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(6)若联合制碱法中,每通入
35.【化学―选修 物质结构与性质】(15分)
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
A
E
G
R
X
Z
请根据上表回答下列问题:
(1)G元素基态原子的电子排布式为 ,其气态氢化物易液化,其原因是 。
(2)XR2中,X原子的轨道杂化类型为 ,化合物ER2的熔点较XR2低,其原因是 。
(3)E、G、R三种元素的第一电离能由大到小的顺序是 (用元素符号填空)。
(4)由A、E、G、R四种元素所形成的微粒中互为等电子体的有多组,请写出其中两组的化学式 。
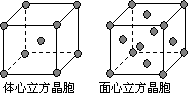 (5)单质Z的晶体在1183 K以下时为体心立方堆积,在1183 K以上时为面心立方堆积,其晶胞结构如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Z原子的个数之比为
。Z3+比Z2+更稳定一些,其原因可能是
。
(5)单质Z的晶体在1183 K以下时为体心立方堆积,在1183 K以上时为面心立方堆积,其晶胞结构如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Z原子的个数之比为
。Z3+比Z2+更稳定一些,其原因可能是
。
36.【化学―选修 有机化学基础】(15分)
Ⅰ.相对分子质量不超过100的某有机物A,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色,且其完全燃烧只生成CO2和H2O。经分析,其含氧元素的质量分数为37.21 %。经核磁共振检测发现其氢谱如下:
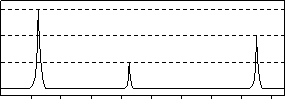

(1)A的分子式为 ,其结构简式为 。
Ⅱ.我国茉莉花茶产量约占花茶总量的90 %以上,茉莉鲜花香气清雅,具有很高的经济价值和很好的药理作用。构成茉莉花香气的成份有多种,如苯甲醇、芳樟醇、乙酸苯甲酯等。乙酸苯甲酯既可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成,它的一种合成路线如下:
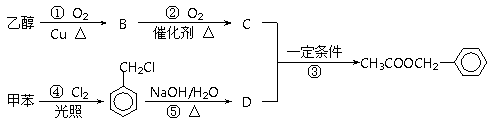

请回答下列问题:
(2)D的结构简式为 。
(3)反应①的化学方程式为 。
(4)反应③的化学方程式为 ,其反应类型为 。
(5)反应 (填序号)原子的理论利用率为100 %,符合绿色化学的要求。
(6)写出符合下列条件的乙酸苯甲酯的一种同分异构体的结构简式:①含有苯环结构;②属于酯类物质。 。
37.【生物―选修1 生物技术实践】(15分)
乙醇等“绿色能源”的开发备受世界关注。利用玉米秸秆生产燃料酒精的大致流程为:

(1)玉米秸秆预处理后,因该选用 酶进行水解,使之转化为发酵所需的葡萄糖。
(2)从以下哪些微生物中可以提取上述酶? (多选)
A、酿制果醋的醋酸菌 B、生长在腐木上的霉菌
C、制作酸奶的乳酸菌 D、生产味精的谷氨酸棒状杆菌
E、反刍动物瘤胃中生存的某些微生物
(3)若从土壤中分离生产这种酶的微生物,所需要的培养基中的碳源为 。
38.【生物―选修3 现代生物科技专题】(15分)
科技工作者在研究哺乳动物“乳腺发生器”成功后,“膀胱生物发生器”的研究也取得了一定进展。最近,科学家培养出一种转基因小鼠,其膀胱上皮细胞可以合成人的生长激素并分泌到尿液中。请回答:
(1)通常采用____________技术检测外源基因是否插入了小鼠的基因组。
(2)在研制膀胱生物反应器时,应使外源基因在小鼠的________细胞中特异表达。
(3)为使外源基因在后代长期保持,可将转基因小鼠细胞的_________转入________细胞中构成重组细胞,使其发育成与供体具有相同性状的个体。该技术称为______________。
2009年鞍山市高中毕业班第一次质量调查
一、选择题:
 1、C 2、D 3、C 4、A 5、B 6、C 7、A 8、C 9、A 10、C 11、B
1、C 2、D 3、C 4、A 5、B 6、C 7、A 8、C 9、A 10、C 11、B
12、D 13、A
二、不定向选择题:
14、C 15、B 16、ABC 17、A 18、B 19、C 20、ABC 21、ABC
三必答题:
22、(15分)
(1)3.
(3)①R1 ,(2分) ② 见答图1(2分)③BD(2分)
23、(15分)
(1)由题图可知雪橇开始做加速度逐渐减小的加速运动,最后作匀速直线运动。(3分)
(2)当雪橇的速度为
a=2.
(3)当雪橇的速度为
mgSinθ―μmgCosθ―kv=ma(3分)
当雪橇匀速运动时速度Vm=
mgSinθ=μmgCosθ+kVm(3分)
两式联立解得k=37.5,μ=0.125(2分)
24、解:(1)小球做匀速圆周运动时合力大小一定,方向垂直与速度方向指向圆心,所以重力和电场力平衡,洛仑兹力做向心力,故有
mg=Eq,解得E=mg/q 方向向上(2分)
(2)由平抛运动知识得
 d=VOt (1分) OP=VYt/2 (1分) 又有VY/VO=tan600(1分)
d=VOt (1分) OP=VYt/2 (1分) 又有VY/VO=tan600(1分)
联立解得OP=3d/2(1分)
由圆运动知识得到
BqV=mV2/R (1分)
由题意得
V0/V=Cos600(1分)
 d=2RSin600 (1分) 解得V0=Bqd/2m(1分)
d=2RSin600 (1分) 解得V0=Bqd/2m(1分)
(3)由题意可知带电小球的运动周期应等于从P运动到Q所用时间的两倍与从Q到O的圆运动经历的时间之和
t1= d/V0 (1分) t2=2T0/3 (1分) T0=2πm/Bq(1分)
d/V0 (1分) t2=2T0/3 (1分) T0=2πm/Bq(1分)
解得T=2t1+t2=m(4π/3+2 )/Bq(1分)
)/Bq(1分)
因每个周期发生的位移为 d,所以在足够长的时间内沿X轴方向的平均速度为
d,所以在足够长的时间内沿X轴方向的平均速度为
V= d/T=3
d/T=3 Bq d/(4π+6
Bq d/(4π+6 )(3分)
)(3分)
25.本题共14分,每空2分
(1)2NaCl+2H2O 2NaOH+H2↑+Cl2↑(2分) (2)较低温度(2分)
2NaOH+H2↑+Cl2↑(2分) (2)较低温度(2分)
(3)2Fe3++3ClO―+10OH―=2FeO―4+3Cl―+5H2O(2分) (4)AC(2分)
(5)K2FeO4具有强氧化性(2分); 氢氧化铁胶体(2分) (6)KNO3、KCl(2分)
26.本题共15分
(1)NO2、SO2(2分); 0.3(2分); 3(
(2)SO2+Ca(OH)2=CaSO3↓+H2O(2分)、2CaSO3+O2+4H2O=2CaSO4?2H2O(2分)
(3)①释放(2分) ②32(L/mol/)(3分,没有单位也可)
27.本题共14分
(1)甲方案不易控制通入CO2的量(2分); 乙方案过程繁琐,操作复杂(2分)
(2)将NaOH溶液分为均等的两份(1分),向其中一份通入过量的CO2(1分),然后再与另一份NaOH溶液混合(1分),所得溶液即为纯Na2CO3溶液
(3)CaCl2(或BaCl2等)(2分); 有白色沉淀产生(1分)
(4)能(2分); 固体样品的质量和沉淀的总质量(2分)
28、(15分)回答下列I、II题:
I、(3分)(1)基因重组(杂交育种);(1分)
(2)基因工程或转基因;(1分)
(3)培育出的个体是纯合子,后代不发生性状分离;(1分)
Ⅱ.(12分) ⑴ ①实验前对该组小鼠的活动情况进行观察并记录。 (2分)
②将该组小鼠各注射等量适宜浓度的胰岛素溶液,观察并记录。 (2分)
③―段时间后,当小鼠出现低血糖症状后,给每只小鼠注射等量适宜浓度的葡萄糖
溶液,观察并记录。 (2分)
(2)①注射胰岛素溶液前,小鼠活动正常 (2分)
②注射胰岛素溶液后,小鼠出现低血糖症状 (2分)
③注射葡萄糖溶液后,小鼠的低血糖症状缓解 (2分)
29、(24分)
I、(1)消化酶(或蛋白酶)(2分) 细胞呼吸 (2分) ATP。(2分)
(2)溶酶体 (2分)
(3)核糖体 (2分) 脱水缩合 (2分)
II、【答案】1.实验步骤②中暗室用红色安全灯是错误的.应改为用绿色安全灯(此项若不改,在对照中提到也给分);(2分)
2.实验步骤⑤中的“葡萄糖”是错误的。应改为“淀粉”;(2分)
3.未设对照。对照的做法是:a.装置同题干中的步骤①。但玻璃罩内用同一种生长状况相同的另一株植物代替题干中的植物。用一杯清水代替NaoH溶液.(2分) b.将上述植物及装置放在暗室中饥饿。消耗掉叶片内贮藏的有机物。暗室装有绿色安全灯;(2分) c.重复题干中的步骤③④ (2分) d.重复改正后的题干中的步骤⑤(2分)
四、选答题:
30、【物理-----选修2―2】
(1)(6分)2 :1(3分),3 :2(3分)
(2)(9分)由有固定转动轴物体的平衡条件得
FLSin370=m1gL/2+m2gL +mgL/2(7分)
解得:F=433(N) (2分)
31、(1)(6分)A
(2)(9分)解:①由玻意耳定律得
P0(VA―V)+NP0V0=P(VA―V)
代入数据解得N=18次 (5分)
②由玻意耳定律得
P(VA―V)=P0(VA―V+△V)
代入数据解得△V=
32、(1)(6分)CD
(2)(9分)解:①在B点由折射定律得到Sin600/Sinα=
解得α=300(2分)
在底面上C点由折射定律得到Sinα/Sinβ=1/
解得β=600(2分)
在三角形OCB中OC=BC= R/3(1分)
R/3(1分)
所以d/OC=Cot300 解得d=R/3(1分)
②由于蓝光的折射率大于红光的折射率,因此光线2经半圆柱体两次折射后偏折更大,此时的d将比上述结果小一些。(2分)
33、【物理-----选修3―5】
(1)(6分)B
(2)(9分)解:(1)弹簧将物块和小车弹开的过程中有动量守恒定律得
MV=mv (2分)
物块离开P点后由平抛运动相关知识得
H=gt2/2 (1分)
(v+V)t=L (2分)
三式联立解得物块速度v=3.
(2)弹簧将物块和小车弹开的过程中弹性势能转化为小车和物块的动能,所以有
E=MV2/2+mv2/2=5.6J (3分)
34.本题共15分
(1)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl(2分)
(2)CO2(1分); NH3(1分)
(3)Na2CO3(1分)、NH4Cl(1分); CaCl2(1分)、NaCl(1分)
(4)不需要(1分); CaCO3+2NaCl=Na2CO3+CaCl2(2分)
(5)b(1分)
(6)94.3 %(2分); 不产生无用的CaCl2(或提高了食盐的转化率等等)(1分)
35.本题共15分
(1)1s22s22p3(1分); 氨分子之间有氢键(2分)
(2)sp3(2分); CO2属于分子晶体,SiO2属于原子晶体(2分)
(3)N>O>C(2分)
(4)CH4和NH+4、NH3和H3O+、CO2和N2O、CO和N2(每组1分,共2分)
(5)1∶2(2分); Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态(2分)
36.本题共15分
(1)C4H6O2(2分); CH2=C(CH3)COOH(2分)
(2)
 (2分) (3)2CH3CH2OH+O2
(2分) (3)2CH3CH2OH+O2
 2CH3CHO+2H2O(2分)
2CH3CHO+2H2O(2分)
(4)
 +CH3COOH→
+CH3COOH→
 +H2O(2分);
+H2O(2分);
酯化(或取代)反应(1分)
(5)②(2分) (6)
 (其它合理答案也可)(2分)
(其它合理答案也可)(2分)
37、【生物-----选修1生物技术实践】(15分)
(1)纤维素 (2)B、E (3)纤维素
38、【生物----选修3现代生物科技专题】(15分)
(1)DNA分子杂交(3分) (2)膀胱上皮 (3分)
(3) 细胞核 ; 去核的卵; 核移植(或克隆) (3分)