武汉市第49中学2009届高三第十九套理科综合试题卷2009.5.21
总分值:300分 考试时间:150分钟
本试卷分为第I卷(选择题)和第II卷(非选择题)两部分。
命题人:物理 张国圣 化学 严和平 生物 王家太
 |
本卷所需用相对原子质量:H:1 O:
第I卷(选择题,共126分)
一、选择题(在以下各题的四个选项中,只有一个选项是符合题目要求。每小题6分,共78分)
1.下图是验证呼吸作用产生二氧化碳的实验装置,在透明的容器B中放入湿润的种子。以下说法中正确的是 ( )
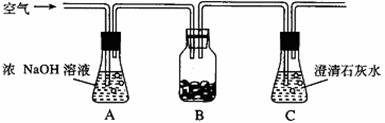
A.在光照条件下,澄清石灰水不会变混浊
B.种子不进行光合作用,检测到的二氧化碳是呼吸作用产生的
C.在黑暗条件下,种子不进行呼吸作用
D.光照条件下若澄清石灰水变混浊,是因为光照下种子在单位时间内光合作用消耗的二氧化碳少于呼吸作用产生的二氧化碳
2.利用细胞工程方法,以SARS病毒核衣壳蛋白为抗原制备出单克隆抗体。下列相关叙述正确的是 ( )
A.用纯化的核衣蛋白反复注射到小鼠体内,产生的血清抗体为单克隆抗体
B.体外培养单个效应B细胞可以获得大量针对SARS病毒的单克隆抗体
C.将等量效应B细胞和骨髓瘤细胞混合,经PEG诱导融合后的细胞均为杂交瘤细胞
D.利用该单克性隆体与SARS抗原特异性抗原决定簇结合的方法可诊断出病毒感染者
3.下列关于酶的说法正确的是 ( )
A.酶均能与双缩脲试剂发生紫色反应
B.将溶液pH值由
C.RNA聚合酶结合位点位于基因编码区上游
D.逆转录酶普遍存在于正常动物细胞中
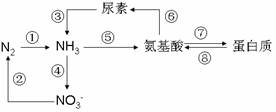 4.下图表示几种含氮物质之间相互转化的关系,下列依据此图的表述中正确的是 ( )
4.下图表示几种含氮物质之间相互转化的关系,下列依据此图的表述中正确的是 ( )
A.⑤⑦是异化作用的过程,⑥⑧是同化作用的过程
B.完成③过程的生物在生态系统中的地位属于消费者
C.土壤疏松可促进④过程,氧气不足可抑制②过程
D.部分细菌、放线菌、蓝藻可以完成①过程,它们的细胞结构均没有核膜
5.下图表示单位面积放牧量与生产者的净生产量(生产者净生产量是指其同化量减去呼吸消耗量)的关系,虚线表示未放牧时草原中生产者的净生产量,下列有关说法正确的是( )
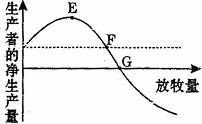
A.草原生态系统营养结构简单,稳定性弱于森林生态系统
B.适度放牧可以促进生产者的净生产量增加
C.适度放牧可以使生产者同化量中的大部分流向放养的牲畜.从而获得最大收益
D.E点所对应的放牧量为该草原的最大控制放牧量
6.下列说法不正确的是
A.NaCl和SiC晶体溶化时,克服粒子间作用力的类型不相同
B.将烧黑的铜丝插入酒精灯火焰的焰心又变红色光亮
C.
H2SO4(aq) + 2NaOH(aq) == Na2SO4(aq) +2H2O(l);△H = -114.6kJ/mol
 D 将铜片放入浓硫酸无明显实验现象,说明铜在冷的浓硫酸中发生钝化
D 将铜片放入浓硫酸无明显实验现象,说明铜在冷的浓硫酸中发生钝化
7.阿佛加德罗常数约为6.02×1023mol-1,下列说法正确的是
 A.标准状况下,
A.标准状况下,
B.常温下,
C.0.3molNO2与足量水反应转移电子数为0.3×6.02×1023
D.0.05molC15H32分子中含有的共价键为2.3×6.02×1023
8.下列说法可以实现的是
①酸性氧化物在一定条件下均能与碱发生反应 
②弱酸与盐溶液反应可以生成强酸
③发生复分解反应,但产物既没有水生成,也没有沉淀和气体生成
④两种酸溶液充分反应后,所得溶液呈中性
⑤有单质参加的反应,但该反应不是氧化还原反应 
⑥两种氧化物发生反应有气体生成
A.①②③④⑤⑥ B.只有①②④⑤ C.只有②③④⑥ D.只有②④⑤
9.下列溶液中离子浓度的关系一定正确的是
A.Na2CO3和NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
B.一元弱碱MOH对应的盐MCl溶液中:c(Cl-)>c(H+)>c(M+)>c(OH-)
C.等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:
D.pH=3的一元酸HX和pH=11的一元碱MOH等体积混合:c(M+)=c(X-)>c(H+)=c(OH-)
10.提纯下列物质的方法正确的是
①乙醇中混有苯酚(氢氧化钠溶液,蒸馏)
②二氧化硅混有碘(加热)
③硝酸钾中混有氯化钠(溶解,蒸发,结晶)
④氢氧化铁胶体中混有氯化钠(过滤)
⑤生石灰中混有石灰石(溶解,过滤)
⑥乙酸乙酯中混有乙酸溶液(饱和碳酸钠溶液,分液)
⑦食盐中混有氯化铵(加热)
⑧高级脂肪酸钠溶液中混有丙三醇(盐析,过滤)
A.②③④⑤⑥⑦ B.①②③⑥⑦⑧ C.①②③⑤⑥⑧ D.②③④⑥⑦⑧
11.可逆反应A(g)+3B(g) 
A.甲中A的转化率为75%
B.甲、乙中C的体积分数相同
C.达到平衡后,再向乙中加入0.25molA、0.75molB、1.5molC,平衡向生成C的方向移动
D.乙中的热化学反应方程式为 A(g)+3B(g);△H=+Q2 kJ/mol
A(g)+3B(g);△H=+Q2 kJ/mol
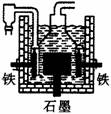 12.1807年化学家戴维用电解熔融氢氧化钠制得钠,4NaOH(熔)
12.1807年化学家戴维用电解熔融氢氧化钠制得钠,4NaOH(熔)  4Na+O2↑+2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH
4Na+O2↑+2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑
B.盖?吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖?吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D.目前常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极
13.2008年2月,湖北又报道某水域爆发蓝藻。保护环境,保护水资源刻不容缓。蓝藻的形成是由于含N、P等元素的废水排入水域,引发蓝藻的疯狂生长。通过定量实验,分析得知某蓝藻的组成为(质量分数):C―35.80%,O―49.50%,P―0.87%,H―7.37%,N―6.31%。则该蓝藻的化学式为:
A.C106H263O110N16P B.C106H263O111N15P C.C106H262O111N17P D.C105H262O110N14P
二、选择题(本题包括8小题,每小题6分,共48分。每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得6分,选对但不全的得3分,有选错的得0分)
14.根据热力学定律和分子动理论,下列说法不正确的是
A.布朗运动是液体分子的运动,它说明了分子在永不停息地做无规则运动
B.密封在容积不变的容器内的气体,若温度升高,则气体分子对器壁单位面积上的平均作用力增大
C.第二类永动机不可能制造成功的原因是因为能量既不会凭空产生,也不会凭空消失,只能从一个物体转移到另一个物体,或从一种形式转化成另一种形式
D.根据热力学第二定律可知,热量能够从高温物体传到低温物体,但不可能从低温物体传到高温物体
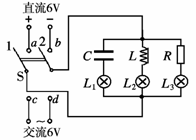 15.如图所示电路,L1、L2、L3是三盏相同的电灯,当双刀双掷开关S的1、2接线柱与c、d两端连接时, L1、L2、L3的发光情况相同,若将开关S的1、2接线柱与a、b两端连接时,则稳定后观察到的现象是
15.如图所示电路,L1、L2、L3是三盏相同的电灯,当双刀双掷开关S的1、2接线柱与c、d两端连接时, L1、L2、L3的发光情况相同,若将开关S的1、2接线柱与a、b两端连接时,则稳定后观察到的现象是
A. L1不亮,L2比L3亮
B.L1不亮,L2、L3两盏电灯的亮度相同
C L1、L2、L3三盏电灯的亮度相同
D.L1不亮,L3比L2亮
16.在水面下同一深处有两个点光源P. Q能发出不同颜色的光,当它们发光时,在水面上看到P光照亮的水面区域大于Q光,以下说法正确的是
A.P光的波长大于Q光
B.P光在水中的传播速度小于Q光
C.P光的光子能量小于Q光
D.让P光和Q光通过同一双缝干涉装置,P光的条纹间距小于Q光
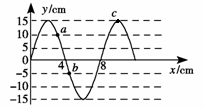 17.如图所示为一列简谐横波t时刻的图象,已知波速为
17.如图所示为一列简谐横波t时刻的图象,已知波速为
A.振源的振动频率为0.25Hz
B.从t时刻起若质点a比质点b先回到平衡位置,则波沿x轴负方向传播
C.t时刻质点a、b、c所受的回复力大小之比为2∶1∶3
D.从t时刻起经过5.0s,质点a、b、c通过的路程均为
 18.嫦娥一号”月球探测卫星于
18.嫦娥一号”月球探测卫星于
A.氘和氦3的核聚变反应方程式: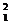 H+
H+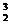 He→
He→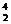 He+X,其中X是中子
He+X,其中X是中子
B.氘和氦3的核聚变反应释放的核能约为17.9MeV
C.一束太阳光相继通过两个偏振片,若以光束为轴旋转其中一个偏振片,则透射光的强度不发生变化
D.通过对月光进行光谱分析,可知月球上存在氦3元素
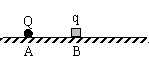 19.如图所示,在粗糙、绝缘且足够大的水平面上固定着一个带负电荷的点电荷Q。将一个质量为m带电荷为q的小金属块(金属块可以看成为质点)放在水平面上并由静止释放,金属块将在水平面上沿远离Q的方向开始运动。则在金属块运动的整个过程中
19.如图所示,在粗糙、绝缘且足够大的水平面上固定着一个带负电荷的点电荷Q。将一个质量为m带电荷为q的小金属块(金属块可以看成为质点)放在水平面上并由静止释放,金属块将在水平面上沿远离Q的方向开始运动。则在金属块运动的整个过程中
A.电场力对金属块做的功等于金属块增加的机械能
B.金属块的电势能先减小后增大
C.金属块的加速度一直减小
D.电场对金属块所做的功一定等于摩擦产生的热
 20.如图所示,物体A置于物体B上,一轻质弹簧一端固定,另一端与B相连,现从弹簧处于压缩状态开始释放A、B,在弹簧的弹性限度内,A、B在光滑的水平面上做简谐运动,并保持相对静止。若取向右为正方向,则从释放开始,A、B向右运动的整个过程中,物体A的速度v和所受摩擦力Ff随时间变化关系图象正确的是
20.如图所示,物体A置于物体B上,一轻质弹簧一端固定,另一端与B相连,现从弹簧处于压缩状态开始释放A、B,在弹簧的弹性限度内,A、B在光滑的水平面上做简谐运动,并保持相对静止。若取向右为正方向,则从释放开始,A、B向右运动的整个过程中,物体A的速度v和所受摩擦力Ff随时间变化关系图象正确的是
 |
21.据报道,我国将于今年十月发射首个火星探测器“萤火一号”,假设其发射过程为:先以第一宇宙速度环绕地球表面飞行,再调整速度进入地火转移轨道,最后再一次调整速度以线速度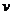 环绕火星表面飞行。若认为地球和火星都是质量分布均匀的球体,已知地球和火星的半径之比为
环绕火星表面飞行。若认为地球和火星都是质量分布均匀的球体,已知地球和火星的半径之比为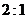 ,密度之比为
,密度之比为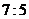 ,则
,则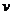 约等于
约等于
A.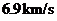 B.
B.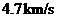 C.
C. D.
D.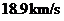
第II卷(非选择题,共174分)
本卷共11小题,共174分。考生请直接用专用签字笔答在答题卡上。
22.I.(8分)如图甲所示,某同学设计了一个用打点计时器验证动量守恒定律的实验:在光滑水平面上,小车A的左端粘有橡皮泥,小车A受到外界水平冲量作用后做匀速运动,与原来静止在前方的小车B相碰并粘合成一体,继续做匀速运动。
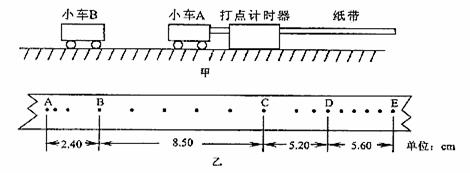
在实验得到的纸带上选取五个计数点分别为A.B.C.D.E,测得AB.BC.CD.DE的长度如图所示。已知打点计时器所用电源频率为50Hz,小车A的质量为0.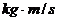 ;碰后小车的速度可利用纸带 段数据求出,且两小车的总动量
;碰后小车的速度可利用纸带 段数据求出,且两小车的总动量
为
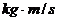 。(计算结果保留三位有效数字)
。(计算结果保留三位有效数字)
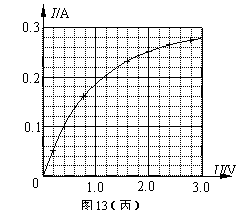
Ⅱ.(10分) 图13甲为某同学测绘额定电压为2.5V的小灯泡的I―U图线的实验电路图.
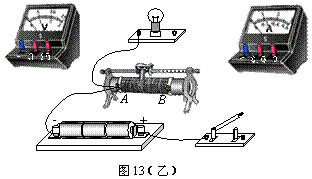
(1)用笔画线代替导线,将图13(乙)中的实验电路连接成完整试验电路。
(2)开关S闭合之前,图13(乙)中滑动变阻器的滑片应该置于 (选填“A端”.“B端”或“AB正中间”)。
(3)已知小灯泡灯丝在
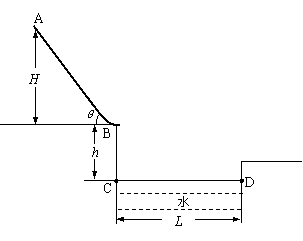 23.(15分)如图所示为游乐场内一水上娱乐设施的模型。AB为与水平方向成夹角
23.(15分)如图所示为游乐场内一水上娱乐设施的模型。AB为与水平方向成夹角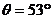 的倾斜滑道,滑道斜面与滑水者间的动摩擦因数
的倾斜滑道,滑道斜面与滑水者间的动摩擦因数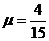 ,滑道底端B处与一小段末端水平的光滑圆弧(长度可忽略)连接,CD为水面,B端与水面高度差h=
,滑道底端B处与一小段末端水平的光滑圆弧(长度可忽略)连接,CD为水面,B端与水面高度差h=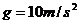 ,
,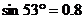 ,
,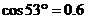 )
)
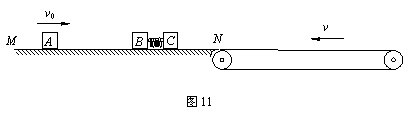
24.(19分)图11所示为研究某种弹射装置的示意图,光滑的水平导轨MN右端N处与水平传送带理想连接,传送带足够长,皮带轮沿逆时针方向转动,带动皮带以恒定速度v=
(1)求滑块C在传送带上向右滑动距N点的最远距离sm;
(2)求弹簧锁定时的弹性势能Ep;
(3)求滑块C在传送带上运动的整个过程中与传送带之间因摩擦产生的内能Q。
 |
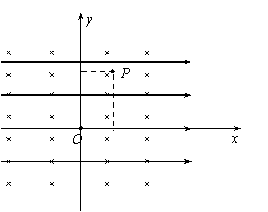 25.(20分)如图所示,匀强磁场方向垂直纸面向里,匀强电场方向水平向右,直角坐标系xoy的原点O处有一能向各个方向发射带电粒子(不计重力)的放射源。当带电粒子以某一初速度沿y轴正方向射入该区域时,恰好能沿y轴做匀速直线运动。若撤去磁场只保留电场,粒子以相同的速度从O点射入,经过一段时间后通过第一象限的P点,P点坐标为(L,
25.(20分)如图所示,匀强磁场方向垂直纸面向里,匀强电场方向水平向右,直角坐标系xoy的原点O处有一能向各个方向发射带电粒子(不计重力)的放射源。当带电粒子以某一初速度沿y轴正方向射入该区域时,恰好能沿y轴做匀速直线运动。若撤去磁场只保留电场,粒子以相同的速度从O点射入,经过一段时间后通过第一象限的P点,P点坐标为(L, )。若撤去电场,只保留磁场,让粒子以相同速率从O点射入,求:
)。若撤去电场,只保留磁场,让粒子以相同速率从O点射入,求:
⑴粒子在磁场中运动的半径;
⑵若要使粒子射出后仍能通过P点,求粒子从O点射出时的速度方向。
26.(13分)现有原子序数依次增大的A、B、C、D、E、F、G七种短周期主族元素,已知A
原子核内无中子,A、B、D三元素的核电荷数之和较G元素的核电荷数少2;D元素原
子的最外层电子数较次外层多4;E元素的原子半径是短周期主族元素中最大;F2- 及
G- 两种阴离子的电子层结构与氩原子相同。
(1)用电子式表示化合物AG的形成过程: 。
(2)电解EG的水溶液的离子化学方程式是 。
 (3)下列变化中的物质均为上述七种元素间形成的单质或化合物间的变化,某些反应条件及某些物质已略去,请按要求写一例化学方程式或回答有关问题。
(3)下列变化中的物质均为上述七种元素间形成的单质或化合物间的变化,某些反应条件及某些物质已略去,请按要求写一例化学方程式或回答有关问题。
①若X、Y均为气态氢化物,则X与Y反应的化学方程式是 。
②若X、Y均为组成元素相同的酸式盐,则X与Y反应的化学方程式是 。
③若X、Y均为二元酸,则X与Y反应的化学方程式是 。
④若X、Y均不属于盐类,但两者组成元素相同(均含四种元素),其相对分子质量之差为14,且两者既能与NaOH溶液反应,又能与盐酸反应。则X、Y中相对分子质量最小的物质是 。
27.(15分)A、G均为正盐, A暴露在空气中可转化为G, D、E均为有刺激性气味的气体,D使湿润的红色石蕊试纸变蓝,在一定条件下有如下转化关系(有些反应物及反应条件略去):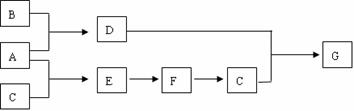
(1)A为 ;C为 (均填名称)
(2)A与C作用的离子反应方程式为 ;
E生成F的化学反应方程式为 。
(3)G的水溶液显 性(填酸或碱);
其原因是(用离子方程式表示) 。
28.( 17 分)类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成 Fe ( NO3)3、,但当铁过量时,产物是 Fe (NO3 )2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 C12 足量时生成 FeC13 , 当铁粉过量时产物是 FeCl2。为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的 C12 中点燃,取其表面生成物并分别编号为 A、B ,然后通过实验确定其成分。探究过程如下:
( 1 )提出假设: A 是 FeCl3, B 是 FeCl2。
( 2 )设计实验方案:分别取 A、B 的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。

( 3 )根据上述实验结论,写出 C12 与铁粉加热时发生反应的化学方程式:
_________________________________________________________________。
( 4 )为进一步探究 FeC13 溶液的性质,他又利用 A 溶液做了如下一些实验,其中明显错误的是____________________。
A.将 A 溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.向 A 溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在 A 溶液中滴加 Na OH 浓溶液,出现红褐色沉淀
D.将 A 溶液加热蒸干并灼烧,得到 FeC13 固体
( 5 )实际应用:
FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有 FeCl3、FeCl2、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收 Cu的方案:
方案1:向废液中加人过量的铁粉,充分反应后,过滤。在所得滤渣中加人足量的盐酸,充分反后,再过滤即得到铜。方案 1 中涉及的四种阳离子的氧化性由强到弱的顺序为:
_____________________________________。
方案2 :在废液中加人适量的盐酸调节溶液的 pH = 1 ,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的 Cu 已全部析出。方案 2 中铜作_________极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)___________________________________________________
方案 2 在电极上直接回收铜,操作上比方案 1 简便,但方案 2 也有不足之处,主要表现为:_____________________________________________________。
29.( 15 分)下列信息对你解题有帮助:Ⅰ.蛋白质在酸性或碱性条件下都能水解;Ⅱ.苯乙酸可表示为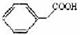 。
。
青霉素(Penicillin)是人类应用最广的抗生素,其结构如下: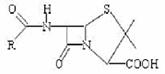 (R不同,可形成不同的青霉素)
(R不同,可形成不同的青霉素)
下表是六种天然青霉素R所对应的结构:
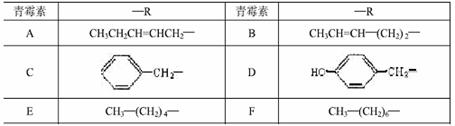
根据表中六种天然青霉素回答:(1)青霉素F的分子式为__________________。(2)属于同分异构体的是______________。(3)只用一种试剂就可以把其中某种青霉素鉴别出来,该试剂为____________。(4)青霉素D分别与足量盐酸和NaOH溶液反应,消耗HCl与NaOH物质的量之此为_______________。(5)写出上表中的A和D对应的烃基(-R)直接相连形成的有机物与足量的浓溴水反应的化学方程式:__________________________________。
30.(20分)I.根据所学知识回答下列问题:
(1)若检验自来水中的大肠杆菌是否超标,需在培养基中加入 ;若将农田土壤表层中的圆褐固氮菌与其他细菌分离出来,则需要在 的培养基上培养。
(2)青霉菌发酵产生青霉素,青霉素是青霉菌的 代谢产物。在生产和科研中,常选用处于 期的青霉菌作为菌种或研究材料。为了增加青霉素的产量,在生产中可以延长 期,可采用 方法。
(3)配制培养基时,要注意各种营养物质的比例。假如利用谷氨酸棒状杆菌来生产谷氨酸,则在扩大培养阶段的碳氮比是 ,在发酵罐内发酵的碳氮比是 。
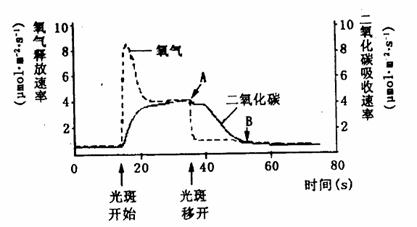
II.阳光穿过森林中的空隙形成“光斑”,它会随太阳的运动和枝叶的摆动而移动。现检测得到一株生长旺盛的植物在“光斑”照射前后CO2吸收速率和O2释放速率,并绘制成下图。请据图回答:
|
 Ⅱ.(10分)(1) 连接电路如答案图(4分)
Ⅱ.(10分)(1) 连接电路如答案图(4分)  ①
据运动学公式得:
①
据运动学公式得: ②
② ③
③ ④
④  ⑤
⑤ m ⑥
m ⑥
 =
= ,v2=0
,v2=0 =
= 2分 解得Ep=4.0 J 1分
2分 解得Ep=4.0 J 1分
 =2.0
s 1分 s1=sm=
=2.0
s 1分 s1=sm= =1.0s 1分 s2=
=1.0s 1分 s2= t2=
t2= 解:⑴电磁场同时存在时,由粒子做匀速直线运动,设入射速度大小为v0得:
解:⑴电磁场同时存在时,由粒子做匀速直线运动,设入射速度大小为v0得: ① 2分
① 2分 ② 2分
② 2分 ③ 2分
③ 2分 ④ 2分
联立以上各式解得:
④ 2分
联立以上各式解得: ⑤ 2分
⑤ 2分 ⑥ 2分
⑥ 2分  .
. ⑦ 2分
⑦ 2分 ⑧ 2分
⑧ 2分 垂直,因此v1与x轴正方向所成夹角为
垂直,因此v1与x轴正方向所成夹角为 ,即
,即 ⑨ 2分
⑨ 2分
 垂直,因此v2与x轴 正方向 所 成 夹 角 为
垂直,因此v2与x轴 正方向 所 成 夹 角 为 ,即
,即 ⑩ 2分
⑩ 2分