2009年福建省龙岩市初中毕业、升学考试
化学试题
(满分:100分 考试时间:60分钟)
注意:
请把所有答案填涂或书写到答题卡上!请不要错位、越界答题!
在本试题上答题无效。
可能用到的相对原子质量:H
一、选择题(本大题10小题,每小题3分,共30分。每小题只有一个选项符合题意,请将正确的选项填涂到答题卡上)
1.据闽西日报报道,2008年龙岩中心城市大气质量首次达到Ⅱ类标准。为了我们的家园天更蓝,水更清,下列做法正确的是
A.任意施用农药化肥 B.关闭落后的水泥厂
C.露天焚烧生活垃圾 D.工业污水任意排放
2.

A.金属材料 B.合成材料
C.无机非金属材料 D.复合材料
3.
A.酒精 B.汽油 C.鞭炮 D.大米
4.下列关于铁、铝、铜的说法正确的是
A.都是银白色的金属 B.都能被磁铁吸引
C.都能与氧气反应 D.都能与硫酸锌溶液反应
5.医院要配制一定质量的0.9%的生理盐水,不需要用到的仪器是
A.托盘天平 B.量筒 C.烧杯 D.试管夹
6.下图所示的实验操作,正确的是
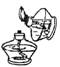
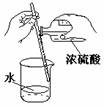
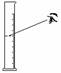
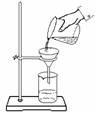
A B C D
7.达菲(C16H31N2PO8)是目前国际社会用来治疗甲型H1N1流感患者的重要药物,下列说法正确的是
A.达菲由五种元素组成
B.达菲分子中含有1个氮分子
C.达菲的相对分子质量是(12+1+14+31+16)
D.达菲在人体内完全反应后只生成水和二氧化碳
8.我国著名化学家张青莲教授主持测定了铟、锑、铈、铕等几种元素的相对原子质量新值。下图是元素周期表中铟元素的内容。下列对图中信息的理解,错误的是
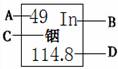
A.原子序数 B.元素符号
C.元素名称 D.电子数
9.春天,公园里百花盛开,香远益清,沁人心脾。从分子的角度解释花香四溢的原因是
A.分子之间都有间隙 B.分子体积极小
C.分子是不断运动的 D.分子是可分的
10.归纳总结是学习的重要方法。小明同学在学习“应用广泛的酸、碱、盐”知识后,结合常见酸(HCl、H2SO4)的性质与变化绘制出下图。图中“ ”两端的物质都能够反应,其中酸碱中和反应生成盐和水,则其他连线的产物也都是盐和水的是
”两端的物质都能够反应,其中酸碱中和反应生成盐和水,则其他连线的产物也都是盐和水的是
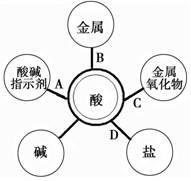
二、填空与简答(本大题5小题,共36分。请将答案填入答题卡相应位置)
11.(8分)化学与生活联系密切,生活中处处有化学。
(1)食醋不慎滴在厨房大理石台面或水泥地面上,立即发出“嘶嘶”响声,并冒气泡,这是因为发生了 变化(填“物理”或“化学”)。
(2)青少年在成长过程中要摄入较多富含蛋白质的食物。常见食物中,富含蛋白质的有
(举出两个例子)。
(3)市场上调味品种类丰富,有碘盐、钙盐、加铁酱油等,其中含有的碘、钙、铁三种元素中属于非金属元素的是 。
(4)农村一些家庭用“沼气”做燃料,沼气的主要成分是甲烷(CH4)。写出甲烷完全燃烧的化学方程式 。
12.(6分)读图是一种重要的能力。下图为甲、乙两种物质的溶解度曲线,请结合图示回答下列问题:
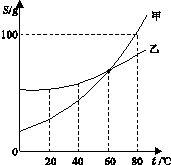
(1)
(2)
(3)当温度为 ℃时,甲、乙两种物质能形成溶质质量分数相同的饱和溶液。
13.(8分)生活离不开水,水既普通又宝贵。
(1)长期饮用硬水对人体健康不利,生活中可用 来区别硬水和软水。
(2)高铁酸钾(K2FeO4)是一种常用的新型、高效的多功能水处理剂,其中铁元素的化合价是 。
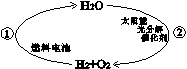
(3)氢气是一种理想的能源,以水为原料大量生产氢能是人类梦寐以求的愿望。科学家提出了一种最经济、最理想的获得氢能源的循环体系(如下图)。图中①和②可用来表示“生产”或“应用”氢能的某一种途径,其中“应用”氢能的是 (填“①”或“②”)。写出体系中任意一个反应的化学方程式 (条件可忽略)。
14.(6分)下图是某化学反应的微观示意图。请结合图示回答下列问题:
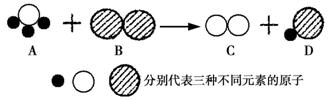
(1)产物C、D中,属于单质的是 。
(2)该反应属于 反应(填基本反应类型)。
(3)在该反应的化学方程式中,A、C的计量数(即化学方程式中的系数)之比为 。
15.(8分)钢铁是非常重要的金属材料。我市马坑铁矿是华东区最大的磁铁矿(主要成分为Fe3O4),总储量达到4.34亿吨。实验室可用下图装置模拟工业炼铁。
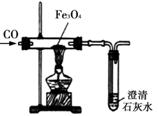
(1)写出CO与Fe3O4反应的化学方程式 。
(2)实验过程中,常在装置图末端的导气管口放一盏燃着的酒精灯(灯焰处于导气管口),这样做的目的是 。
(3)为检验反应后有铁生成,进行如下实验:将反应后的固体取少量放入稀盐酸中,观察到有气泡冒出。写出该反应的化学方程式 。
(4)工业炼铁时还需要石灰石等原料,我市也有着丰富的石灰石资源。请写出石灰石的另一种用途 。
三、实验与探究(本大题2小题,共24分。请将答案填入答题卡相应位置)
16.(10分)中考前,我市各校进行了化学实验操作考查,一些同学用下图所示装置制备常见气体。请回答下列问题:
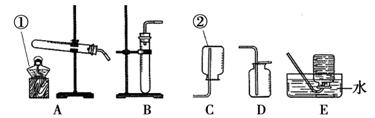
(1)写出图中标号①和②的仪器名称: 、 。
(2)小明用上图B、D装置制取一种常见气体。
①请写出有关反应的化学方程式 。
②检查装置的气密性:先将B装置的导管浸入水中,然后用手握住试管外壁,观察到导管口 (填“有”或“没有”)气泡冒出,表明B装置肯定会漏气。
③如何检验D中的气体已收集满?请写出有关的操作和现象
。
(3)小红同学用A、E装置和高锰酸钾制取并收集气体,要等到有连续稳定气泡冒出时才开始收集,而不是一看到气泡冒出就收集气体,其原因是 。
17.(14分)碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业。某化学兴趣小组的同学对碳酸氢钠的性质进行探究。
实验一:探究碳酸氢钠溶液的酸碱性
用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈 性。
实验二:探究碳酸氢钠的热稳定性
[查阅资料]碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质。
[进行实验]为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如下图所示。

(1)加热一段时间后,观察到烧杯内壁有 。
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊。写出该反应的化学方程式 。
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3。
①他们猜想的依据是 。
②请设计实验检验反应后的固体产物是NaOH还是Na2CO3,并填入下表(只要求填写其中一行。若两行都写,按第一行计分):
实 验 操 作
预期实验现象
结 论
固体产物是Na2CO3,而不是NaOH。
固体产物是NaOH,而不是Na2CO3。
[拓展应用]碳酸氢钠、碳酸钙、氢氧化镁等常用于制作抗酸药,用来治疗胃酸过多。但对于患有胃溃疡(胃黏膜溃烂)的病人在胃酸过多时,却不宜服用碳酸氢钠、碳酸钙等碳酸盐,其原因是 。
四.计算与分析(共10分。请将答案写入答题卡相应位置)
18.为了减少“温室效应”带来的负面影响,世界各国都在限制二氧化碳等温室气体的排放量。有科学家经过研究,发现二氧化碳在一定条件下可转化为有机物乙烯(C2H4,是生产聚乙烯塑料的原料),其化学方程式为:2CO2+6H2=C2H4+4H2O。试回答下列问题:
(1)乙烯中碳元素的质量分数是 (精确到0.1%)。
(2)若用
(3)任何物质都具有两面性,对物质的认识越深入,就越能充分、合理地利用物质为人类服务,如对二氧化碳的认识与应用。请从物质两面性的角度,说说你对氧气的认识(各举一例)。
应 用 氧 气
隔 绝 氧 气