2009年济宁市高中阶段学校招生考试
化学试卷
可能用到的相对原子质置:
H一
第I卷(选择题共16分)
选择题(下列各越只有一个正确选项。其中11~14小题各1分,15~20小题各2分。本大题共16分)
11.化学科学的发展为人类提供了更多的生活、生产资料,下面做法利用了化学变化的是
A.海员蒸馏海水获取淡水
B.工匠融化玻璃吹制各种容器
C.工业上分离液态空气得到氧气、氮气
D.大棚蔬菜生产施用二氧化碳气体提高产量
12.某同学对不同状态水的认识,正确的是
A.气、液、固三种状态的水中,水分子是一样的
B.气态水分子质量小,液态和固态水分子质量大
C.气态水分子不断运动,液态和固态水分子不运动
D.气态水分子间有间隔,液态和固态水分子间没间隔
13.被蚊虫叮咬后,人们往往出现皮肤肿痛。这是因为蚊虫在皮肤内分泌出的酸性物质〔主要成分是甲酸(CH2O2)〕对人的皮肤有较强的刺激作用。下面关于甲酸的说法中,错误的是
A.甲酸是由碳、氢、氧三种元素组成的有机物
B.甲酸分子中有一个碳原子、两个氢原子和两个氧原子
C.甲酸中碳、氢、氧三种原子的个数比为1┱2┱2
D.甲酸中碳、氢、氧三种元素的质量比为6┱1┱16
14.生成新物质是化学变化的基本特征,但现象的变化也可以帮助我们判断化学反应的发生。对下面实验现象的描述中,正确的是
A.镁带在空气中燃烧,产生白色火焰,生成白色固体
B.氢气在空气中燃烧,产生淡蓝色火焰,放出热量
C.石蕊试液滴入氢氧化钠溶液中,氢氧化钠溶液变为红色
D.氢氧化钠溶液滴入浅绿色氯化铁溶液中,有红褐色沉淀生成
15.分析钠原子、钠离子的结构示意图得到的以下说法中,错误的是

A.钠原子有三个电子层,钠离子有两个电子层
B.钠原子、钠离子的质子数都为11
C.一个钠原子在化学反应中可失去一个电子,因此,钠元素为+1价
D.钠原子和钠离子不属于同一种元素
16.人类从石器时代进入铜器时代,继而进入铁器时代,铜作为金属材料一直被广泛应用着。下面冶炼铜的方法中,利用了置换反应的是
①C+2CuO 2Cu+CO2↑
2Cu+CO2↑
②CO+CuO Cu+CO2
Cu+CO2
③H2 + CuO==== Cu + H2O
④Fe + CuSO4 =Cu + FeSO4
A.①②③ B.①③④ C.②③④ D.①②④
17.除去下列物质中少量杂质(括号内为杂质)的方法中,不能达到目的的是
A.CO2气体(HCl) 将气体通过澄清石灰水后干燥
B.Fe粉(Fe2O3) 通入足量一氧化碳气体加热后冷却
C.CaO(CaCO3) 将固体高温加热至质量恒定后冷却
D.KNO3溶液(K2SO4) 加入适量硝酸钡溶液后过滤
18.某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙两种金属分别放入到质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(见下图)。分析图像得到的以下结论中,一定正确的是

A.金属甲比金属乙活泼
B.金属甲比金属乙的相对原子质量大
C.金属乙比金属甲的反应速率大
D.金属乙比金属甲的化合价高
19.小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现右图中所示的所有反应。若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是

A.HCl NaOH BaCl2 Na2SO4
B.HCl Ba(OH)2 Na2SO4 BaCl2
C.H2SO4 Ba(OH)2 Na2SO4 BaCl2
D.H2SO4 NaOH BaCl2 Na2SO4
20.日常生活中的下列做法,正确运用了化学知识的是
①用汽油洗除衣服上的油污
②用砂纸打磨掉铝制品表面的污渍
③加少量亚硝酸盐腌制肉类食品,色泽艳、口感好
④服用胃舒平(主要成分为氢氧化铝)治疗胃酸过多症
A.①② B.②③ C.③④ D.①④
第Ⅱ卷(非选择题共34分)
一、填空与简答(共17分)
1.(3分)日常生活和生产接触到的下列物质中,可用作人类营养物质的有 ,可用于建筑材料的有 ,可作为能源使用的有 。(填序号)
①奶酪 ②大理石 ③洗涤剂 ④葡萄糖 ⑤ 铝合金 ⑥天然气
2.(3分)请按要求完成下列内容:
(1)由C、O两种元素组成化合物的化学式 ;
(2)由H、C、O三种元素组成无机物的化学式 ;
(3)由H、C、O、Na四种元素组成盐的化学式 。
3.(4分)仿照示例,任选两种物质,分别写出它们的一个性质和与之对应的用途:
物质
性 质
用 途
氢气
可燃性
清洁、环保的高能燃料
4.(3分)向
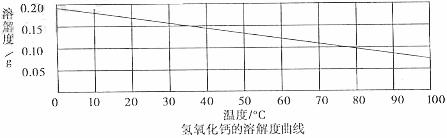
(1)加入氧化钙粉末后,溶液的温度将 (升高、降低或不变);
(2)反应后溶液的质量跟原石灰水相比将会 (增加、减少或不变);
(3)反应后溶液温度恢复至20,跟原石灰水相比,溶质质量分数 (增加、减小或不变)。
5.(4分)硬水中因溶有较多的可溶性钙、镁化合物,给我们的生活、生产带来许多麻烦。大部分地区的地下水主要含有Ca(HCO3)2、Mg(HCO3)2等物质,可通过加热的方法进行软化。
有些地区的地下水因含有CaCl2、MgCl2,简单的加热方法不能将其软化,可加入过量Ca(OH)2、Na2CO3的将水的Ca2+、Mg2+转变成CaCO3、Mg(OH)2沉淀,从而达到软化的目的。若使这种方法,你认为应先加入 后加 ,其中,除Mg2+时发生的化学反应为 (化学方程式表示)。由于去除Ca2+、Mg2+时加入了过量Ca(OH)2、Na2CO3,使软化后的水具有较强的碱性,使用前需用盐酸调整水的酸碱度,以除去水中残存的 。
二、实验与探究(共11分)
6.(1)(6分)下图是实验室制备物质的常用装置,根据装置回答:
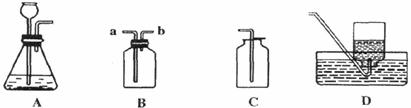
①可用装置A制取的气体有
②装置C可用于收集中① 气体,装置D可用于收集中① 气体,装置B可用于收集中① 气体。
③若用装置B除去二氧化碳中少量的水蒸气,可在装置中装入 ,气体应从 端进入。
(2)(5分)控制变量是科学探究的重要方法之一。小华同学实验中发现:把质量相等的不同物质放入同样一杯水中,有的溶解快,有的溶解多,有的溶解又快又多。是哪些因素影响着物质溶解的快慢与多少呢?
请你参考下表硝酸钾的溶解度随温度的变化关系,以硝酸钾为例,选择一种可能影响硝酸钾溶解快慢的因素设计实验进行探究:
温度(℃)
20
30
40
50
60
70
80
溶解度(g)
31.6
45.8
63.9
85.5
110
138
168
①影响因素:
②实施方案:
③通过实验得出 。实验中,控制不变的因素是 。
三、计算与应用(共6分)
含氮量 ≥46.3%
净 重 50±0.5┧
粒 径 0.85-2.80┨
××化肥厂
(1)尿素属于化肥中的 ;
(2)每袋尿素中有效营养元素的含量不低于 千克。(精确到0。1)
8.家庭食用面碱(主要成分为Na2CO3)中往往混有少量NaCl。李欣同学为测定食用面碱中碳酸钠的含量,设计并进行了以下实验:
①称取面碱样品
②向其中加入足量的CaCl2溶液,至不再生成沉淀为止;
③过滤并将所得沉淀干燥后,称得质量为
请计算:食用面碱中Na2CO3的质量分数是多少?(精确到0。1)