2008-2009学年度潍坊市诸城第二学期九年级期中考试
化学试卷
说明:考试时间120分钟。
可能用到的相对原子质量:H:1 C1:35.5 C:12 O:16 Na:23 Ca:40
第Ⅰ卷(共40分)
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
1.物质是变化的,我们生活在多姿多彩的物质世界里。以下变化中没有新物质生成的是
A.光合作用 B.葡萄酿酒 C.电灯发光 D.铁器锈蚀
2.用下列物质做燃料时,对环境污染最严重的是
A.原煤 B.天然气 C.氢气 D.酒精
3.在日常生活中常说开门七件事:①柴②米③油④盐⑤酱⑥醋⑦茶,你认为其中含有有机物的是
A.只有①②③④⑤⑥ B.只有④
C.除④外全部都有 D.全部含有
4.一些科普读物中常见有下列词汇,其中的颜色不是描述物质的真实颜色的是
A.黑色粉末 B.白色沉淀 C.蓝色液体 D.绿色食品
5.将下列各名词与现象相对应,正确的是
A.氢氧化钠露置在空气中,表面变潮湿――氧化
B.打开装有浓盐酸的试剂瓶瓶塞,瓶口出现白雾――挥发
C.用洗洁精洗去餐具上的油污――溶解
D.冷却热的硝酸钾饱和溶液,出现晶体――蒸发
6.下列物质中,遇水就变得“冷冰冰”的是
A.氢氧化钠固体 B.生石灰 C.硝酸铵 D.浓硫酸
7.某地发现一温泉,水温高达
A.H2SiO4 B.H2SiO
8.下列离子的结构示意图中表示阳离子的是

9.“三元催化器”可将汽车尾气中的有害气体处理为无污染的气体,下图为该反应的微观示意图,其中不同颜色的球代表不同种原子。下列说法错误的是
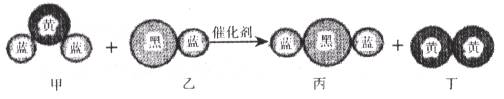
A.乙和丙中所含元素种类相同
B.甲和丁中同种元素化合价相等
C.该反应中共有三种元素
D.反应的化学方程式中乙、丙的化学计量数均为4
10.被蚂蚁、蚊虫叮咬后人会感觉痛痒,这是由于昆虫分泌出的酸性物质有刺激作用,该酸性物质的主要成分是甲酸(HCOOH)。下列有关说法正确的是
A.甲酸溶液能使紫色石蕊试液变蓝
B.甲酸中碳、氢、氧三种元素的质量比是6┱1┱16
C.甲酸由1个碳原子、2个氢原子和2个氧原子构成
D.可选用浓氢氧化钠溶液等碱性物质来涂抹患处
11.小明同学做下列化学实验,在他实验报告的数据中,你认为错误的是
A.用pH试纸测得某盐酸溶液的pH=5.4
B.用10mL的量筒量取某溶液,体积V=8.2mL
C.用托盘天平称量食盐,其质量m=
D.用温度计测得氢氧化钠固体溶于水后所得溶液的温度为
12.小红同学在家做“粗盐提纯”实验,对其做法的认识中,错误的是
A.将粗盐放入玻璃杯中加水溶解――粒子在不断运动
B.溶解时用筷子搅拌――加快溶解速率
C.用自制净水器过滤粗盐水――可将粗盐水变为纯净物
D.实验时不用一次性塑料杯或纸杯――保护环境要从身边小事做起
13.下列事实不能说明Zn比Ag活泼的是
A.自然界中没有以单质形式存在的Zn,而有以单质形式存在的Ag
B.Zn的熔点为
C.Zn能与稀硫酸反应,Ag则不能
D.Zn能与AgNO3溶液反应置换出Ag
14.下列物质中属于纯净物的是
A.医用酒精 B.大理石 C.干冰 D.酸奶
15.科学家利用自然界存在的N2制取出N3,后来又制出N5。N5是一种重要的燃料,科学家设想用N5做燃料发射火箭。下列关于N5的说法中正确的是
A.合成N5的变化属于物理变化 B.N5是由5个氮原子构成的化合物
C.N5分子是由氮元素组成的 D.N5与N2、N3都是氮单质
16.下图为实验室制取氢气的发生装置。若液面刚好不与锌粒接触而又无酸液可加,要得到氢气,可从长颈漏斗中加入的适量试剂是
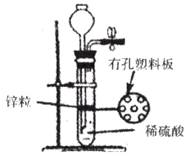
①食盐水 ②硫酸钠溶液 ③氯化钡溶液 ④碳酸钠溶液
A.①②③ B.①②④ C.②③④ D.①③④
17.下列实验方法的归纳正确的是
A.给玻璃仪器加热时,均应垫上石棉网
B.过滤时,将待过滤的混合物直接倒入漏斗中
C.用托盘天平称量物质时,先加小砝码,再依次加较大的砝码
D.取用液体药品可用滴管吸取,也可直接倾倒
18.甲、乙、丙分别是酸或碱的水溶液,pH依次为1,5,14。下列图形合理的是
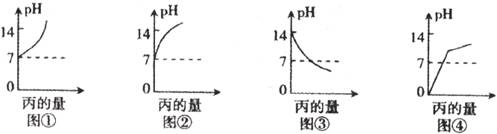
A.图①表示甲中滴入丙 B.图②表示乙中滴入丙
C.图③表示丙中滴入乙 D.图④表示甲中滴入乙
19.“探险队员”――硫酸,不小心走进了由许多“吃人野兽”(即能与硫酸发生化学反应的物质)的小山,逃生路线由许多种,有一条路线处处是陷阱,即为入口→③→⑤→⑦→⑨→出口,则该线路涉及的物质为
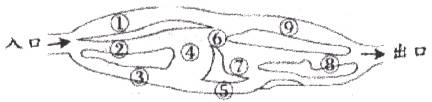
A.Zn、Fe(OH)3、Cu、Fe B.SO3、Cu、NaCl、HCl
C.Na2CO3、Fe(OH)3、Zn、Fe D.SO3、Cu、NaCl、CuO
20.对下列实验过程的评价正确的是
A.烧碱溶液中是否混有氯化钠,可先加稀盐酸,再加硝酸银溶液即可
B.某溶液中滴加氯化钡溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含有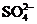
C.某无色溶液中滴入酚酞试液变红色,该溶液一定是碱溶液
D.回收废旧金属,既可以节约资源,又可以防止环境污染
第Ⅱ卷(60分)
二、填空题(29分)
21.2008年北京奥运会火炬在工艺上采用高品质铝合金和中空塑件设计,燃料主要为丙烷,丙烷分子结构模型如下图所示:
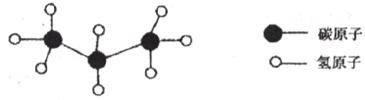
请你就上述信息回答有关问题:
(1)写出丙烷的化学式_________,丙烷在氧气中完全燃烧的产物是__________和__________。
(2)火炬的外壳使用了铝合金材料,请你说出利用这种材料的两大优点:__________ __________,____________________
22.下图是A、B、C三种固体物质的溶解度曲线图。
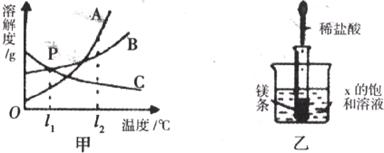
(1)甲图中,t
(2)如乙图所不,
23.在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质)。为了对废液进行处理,某同学做了如下实验:取废液缸上层清液40mL于烧杯中,逐滴滴入碳酸钠溶液至过量,滴人碳酸钠溶液的质量(x)与有关量的变化关系如下图所示。

图中纵坐标(y)轴表示__________,OA段发生反应的化学方程式为_______________,反应进行到B点时,溶液中所含溶质是__________,C点溶液的pH__________7。
24.据媒体透露,顾客反映:某连锁餐饮业“某某豆浆”所提供的油条有氨气的异味。经记者采访,店方承认是用碳酸氢铵和水配成溶液发的面,使油条膨松。以下是记者与“某某豆浆”品控部经理的对话:
记者:“为什么油条有氨气的气味?”
经理:“我们对油条中的碳酸氢铵是定量化标准,对各门店的油条制作采取规范化标准。顾客感到味呛,可能是油温不够所致。因为今天的厨师是生手。”
对稍有化学知识的人来说,经理的话可谓一语道破天机。由以上信息回答:
(1)请把经理所说的话中有科学性错误的写出来。
(2)你可得出碳酸氢铵怎样的化学性质?
(3)传统膨松剂使用的是碳酸氢钠,加热后分解生成碳酸钠、水和二氧化碳。请写出碳酸氢钠分解的化学方程式。
25.某固体氧化物X,经过①②两步反应后,得到红色固体单质C,溶液B只含一种溶质,且是盐。反应物和产物均已给出。
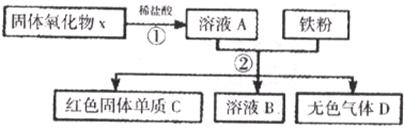
(1)第①步盐酸是否过量?__________,判断根据是_________________________。
(2)写出①中发生反应的化学方程式:______________________________。
(3)写出生成C的化学方程式:______________________________。
三、实验简答题(21分)
26.下图是化学实验中常用的几种装置。
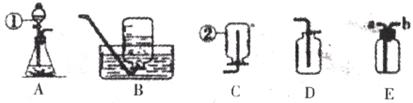
请回答下列问题:
(1)写出有编号的仪器的名称:①__________②__________。
(2)利用上述A、D装置的组合可以制取的一种气体是__________。写出实验室利用此装置制取该气体的反应的化学方程式______________________________。
(3)某同学欲收集一种难溶性气体,认为E装置可以代替B装置。请简述该同学如何利用E装置________________________________________。
27.某兴趣小组为证明氢氧化钠溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
方案一:先用pH试纸测定氢氧化钠溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明氢氧化钠溶液与稀盐酸发生了化学反应。
(1)用pH试纸测定溶液的pH时,正确的操作是:______________________。
(2)简述强调“测得的pH小于
方案二:先在氢氧化钠溶液中滴加几滴酚酞试液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明氢氧化钠溶液与稀盐酸发生了化学反应。该组同学在向氢氧化钠溶液中滴加酚酞试液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞试液,溶液逐渐变成了红色,过了一会儿红色就消失了。该小组同学对这种意外现象的原因做了如下猜想:①可能是酚酞试液与空气中的氧气反应,使红色消失;②可能是酚酞试液与空气中的二氧化碳反应,使红色消失。
(1)为验证猜想①,该组同学做了如下实验:将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴人酚酞试液。实验中“加热”的目的是____________________,“滴入植物油”的目的是____________________。实验结果证明酚酞试液红色消失与空气中的氧气无关。
(2)为验证猜想②,该组同学做了如下实验:取一定量的碳酸钠溶液,在其中滴入酚酞试液,发现溶液也呈红色,由此可以得出以下两个结论:
结论1:说明________ ________________________________;
结论2:说明酚酞试液红色消失与空气中的二氧化碳无关。
(3)该小组同学通过查阅资料得知:.当氢氧化钠溶液浓度很大时,就会出现上述意外现象。请设计实验证明该方案中取用的氢氧化钠溶液浓度过大:
①实验方法__________________________________________________;
②观察到的现象______________________________________________。
方案三:化学反应中通常伴随能量的变化,可借助反应前后温度的变化判断反应的发生。该组同学将不同浓度的盐酸和氢氧化钠溶液各10mL混合,用温度计测定室温下混合前后溶液温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
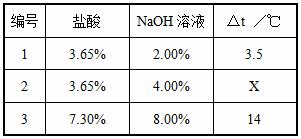

(1)表中X=__________。
(2)某同学在没使用温度计的情况下,通过上图所示装置完成了实验。该同学根据___________________________判断氢氧化钠溶液与稀盐酸发生了中和反应。
四、计算题(10分)
28.现有一瓶未开启的浓盐酸,试剂瓶标签上的部分内容如下图所示,欲将10mL的浓盐酸稀释为7.3%的稀盐酸,需加水多少克?
化学纯
盐酸 含HCl 36.5%
密度
容量 500ml
29.为了测定某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中都加入了 g的白色固体。实验数据如下:
g的白色固体。实验数据如下:
烧杯Ⅰ
烧杯Ⅱ
烧杯Ⅲ
加入CaCl2的质量/g
5.55
12
15
 /g
/g
5
10
10
回答下列问题:
(1)将烧杯Ⅲ蒸干,得到________g固体,该固体由________和________组成(只填化学式)。
(2)样品中碳酸钠的质量分数是多少?