2009年广东省中考模拟考试
化学试卷(十一)
说明:本试题满分100分,考试时间80分钟。
选用的相对原子质量:H:1 C:12 N:14 O:16 Mg:24 Ca:40 I:127
第一卷
一、选择题(本大题14小题,每小题2分,共28分。在每小题列出的四个选项中,只有一个是正确的)
1.物质的下列性质中,属于化学性质的是
A.颜色、状态 B.密度、硬度
C.溶点、沸点 D.还原性、可燃性
2.人体内的一些液体的正常pH范围如下表,正常情况下,这些液体中一定呈酸性的是
血浆
乳汁
唾液
胆汁
胰液
胃液
pH范围
7.35~7.45
6.6--7.6
6.6~7.1
7.1~7.3
7.5~8.0
0.9~1.5
A.胃液 B.血浆 C.乳汁 D.唾液
3.佝偻病患者体内缺少的元素是
A.钙 B.铁 C.锌 D.硒
4.化学反应提供的能量已不能满足人类的需求,需要开发新的能源。下列属于新能源的是
A.煤 B.天然气 C.石油 D.太阳能
5.下列实验操作正确的是
A.将pH试纸浸入溶液中测溶液的pH
B.用酒精灯的内焰给试管中的液体加热
C.实验结束后.将剩余药品倒入指定的容器中
D.为了节约火柴,用燃着的酒精灯点燃另一盏酒精灯
6.开展社会调查活动是同学们了解社会、扩大视野、培养科学素养的社会实践活动,为完成下列调查内容而选择的对象或渠道,不合理的是
调查题目或内容
调查对象或渠道
A.调查一周空气的变化情况
电视、网络、环保部门
B.调查家庭用水情况
同学、家长、居民户
C.调查市场上补钙保健品的种类
保健品经销商、保健医生
D.调查家庭使用塑料的种类、数量
气象部门
7.下列做法不会引起食品安全事故的是
A.用霉变大米煮饭食用 B.用铁强化酱油作调味品
C.用甲醛溶液浸泡水产品并食用 D.用含亚硝酸钠的工业用盐腌制食品
8.下列区别物质的方法错误的是
A.用肥皂水区别软水和硬水 B.用水区别氯化钠和硝酸铵固体
C.用燃烧的方法区别羊毛和涤纶 D.用观察颜色的方法区别O2和CO2
9.用分子的观点解释下列现象,不合理的是
A.酒精燃烧――分子发生了变化 B.汽油挥发――分子大小发生了变化
C.干冰升华――分子间的间隔改变了 D.花香四溢――分子在不断运动
10.研究表明,许多金属氧化物对氯酸钾的分解有催化作用。下表是不同金属氧化物作催化剂,氯酸钾剧烈反应时的温度:
氧化物
氧化铁
氧化铝
氧化铜
氧化镁
剧烈反应的温度/℃
490
540
350
546
实验室用氯酸钾制取氧气,如果不用二氧化锰作催化剂,最好选用
A.氧化铁 B.氧化铝 C.氧化铜 D.氧化镁
11.铁和铜都能与氯化铁溶液反应,反应的化学方程式为: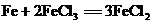 ,
,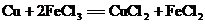 。若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后烧杯中有金属剩余。下列分析正确的是
。若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后烧杯中有金属剩余。下列分析正确的是
①剩余金属只有Fe ②剩余金属一定有Cu
③反应后的溶液中可能有FeCl3 ④反应后的溶液中一定有FeCl2
A.①③ B.②④ C.①④ D.②③
12.X、Y、Z、W是四种不同的金属,为比较金属活动性的强弱,某同学利用这四种金属单质、盐酸、Z的硝酸盐、W的硝酸盐,进行有关实验,结果如下表(能发生置换反应的记为“√”,不能反应的记为“―”,无标记的表示未做该实验)。这四种金属的活动性顺序为
X
Y
Z
W
盐酸
√
―
―
√
Z的硝酸盐
√
W的硝酸盐
√
―
A.X>W>Y>Z B.X>Y>W>Z
C.W>X>Y>Z D.Y>W>Z>X
13.下列各组中的环境问题与治理措施无关的是
A
B
C
D
环境问题
温室效应
土地沙漠化
酸雨
蓝藻爆发
治理措施
减少使用化石燃料
植树造林
回收废旧电池
污水处理后排放
14.向一定量的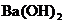 溶液中逐滴加入稀H2SO4,下列图像中V表示加入稀H2SO4的体积,其中正确的是
溶液中逐滴加入稀H2SO4,下列图像中V表示加入稀H2SO4的体积,其中正确的是
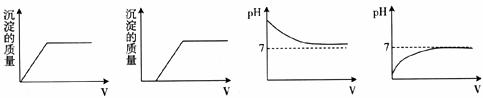
A B C D
第二卷
二、填空题(本大题5小题,共20分)
15.(2分)化学与生产生活紧密相关。请回答:
(1)用活性炭除去冰箱的异味,是利用了活性炭的__________性。
(2)利用CO的__________性,能把赤铁矿石(主要成分是Fe2O3)中的铁冶炼出来。
16.(3分)测定pH值最简单的方法是使用__________,测定时,用玻璃棒蘸取待测溶液,滴在__________上,然后再与标准比色卡对照,便可测出溶液的pH值。若用此法测得土壤的pH值小于5,可以施用适量的__________来改良土壤。
17.(4分)下表摘录了饮用天然矿泉水国家标准的部分内容:
项目
锂
锶
锌
硒
溴化物
碘化物
硅酸
溶解性固体
指标
(mg/L)
≥0.20
≥0.20
≥0.20
≥0.01
≥1.0
≥0.20
≥25.0
≥1000
请分析表中信息,回答以下问题:
(1)表中的锂、锶、锌、硒在这里是指________(填“元素”、“分子”或“原子”)。
(2)饮用天然矿泉水对人体健康有益,原因之一是矿泉水的pH与人体血液的pH相似。已知某种矿泉水的pH为7.2~7.5,该矿泉水的酸碱性为
A.强酸性 B.弱酸性 C.强碱性 D.弱碱性
(3)使用硬水会给生活和生产带来许多麻烦。在日常生活中,人们常用__________的方法来降低水的硬度。如果想知道得到的水是软水还是硬水,我们可以用__________来检验。
18.(5分)金属钛及钛的合金被认为是21世纪重要的金属材料,地壳中的钛矿石主要是金红石(TiO2),TiO2中钛的化合价是________。目前工业上制取钛的方法是:第一步,在高温时,将金红石、炭粉混合并通入氯气(Cl2)制得TiCl4和一种可燃性气体,该反应的化学方程式是___________;第二步,在氩气的环境中,用过量的金属镁在加热条件下与TiCl4反应制得金属钛(氩气不参加反应),该反应的化学方程式是________________________。
19.(6分)在学习酸的化学性质之前,小芳曾用四朵紫色干燥的石蕊小花做了下图中所示的四个探究实验,得出了“CO2溶于水生成酸”的结论。请将各实验的目的或结论填入表格的空格中。

实验序号
(Ⅰ)
(Ⅱ)
(Ⅲ)
(Ⅳ)
小芳的实验现象
石蕊小花不变色
石蕊小花变红色
石蕊小花不变色
石蕊小花变红色
实验的目的和结论
目的:_________
目的:证明酸溶液能使石蕊变红色
目的:_______
结论:________
请判断:
若仅做实验(Ⅳ),小芳得出的结论是______________________________;若不做实验(Ⅱ),小芳得出的结论是______________________________。
三、解答题(本大题2小题,共15分)
20.(8分)小庄因母亲感冒发烧,从药房买了某种阿司匹林水溶片(内服的非处方药,含有可溶于水、具有酸的通性的固体酸),使用过程中出现的一些现象使她产生了研究的兴趣。以下是小庄用剩余药品进行实验的记录:
a.观察药片,为白色片状固体;
b.将其放入水中,看到大量气泡,经检验产生的气体为A;
c.待充分反应后,过滤,得到白色固体与无色澄清滤液;
d.把白色固体分成两份,一份加入试剂B,产生气泡;另一份加入某单质的棕黄色溶液C,生成蓝色物质;
e.在滤液中加入过量试剂D,得到白色悬浊液,过滤,在过滤后得到的白色沉淀与滤液中分别滴加过量试剂B,均产生气体A,且白色沉淀全部溶解。
试根据小庄以上的实验记录,回答下列问题:
(1)根据上述实验过程中的现象可以确定:
①b步骤中产生的气体A为__________(填化学式,下同),e步骤中所用的试剂D为__________;
②该水溶片中肯定含有的物质种类有__________(填序号);
A.单质 B.氧化物 C.碱 D.盐 E.有机物
③写出在e步骤中产生的白色沉淀中加试剂B的化学方程式:_________________。
(2)根据以上实验,小庄认为该药品成分中存在碳酸钡,你是否同意她的结论,为什么?
21.(7分)A~G是初中化学常见的7种物质,其中至少有一种物质是无色气体,且A与G含有相同的金属元素,它们在一定条件下转化关系如下图所示,其中部分反应物或生成物已略去。
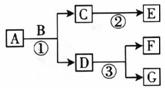
请针对以下两种情况回答问题:
(1)若A中两种元素的质量比为7┱3,F是一种红色金属,则F的化学式为__________;写出反应①、③的化学方程式:①___________________;③___________________。
(2)若F与C常温下可以反应,②、③属于同一种基本反应类型,则A的化学式为__________;写出反应①的化学方程式____________________;反应②的基本反应类型是__________。
四、实验题(本大题2小题,共23分)
22.(11分)碳酸氢铵NH4HCO3是一种常用的化学肥料,易溶于水,受潮时在常温下即分解,温度越高分解越快,分解产物为NH3、CO2、H2O。碳铵遇碱放出密度比空气小的氨气。
(1)碳铵属于化肥中的_______肥,化学性质_______(填“稳定”或“不稳定”);保存时应注意______________________________(写两点)。
(2)某兴趣小组欲在实验室利用如下装置研究碳铵的性质,请你一起参加,完成下列问题:
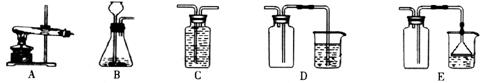
①选择装置______(填编号)进行碳铵固体受热分解的实验,该反应的化学方程式为: _____;应用该装置,实验室还可以进行的实验有:____________________(答一个);
②在装置B中加入碳铵和稀盐酸,将产生的气体通入澄清石灰水中,可观察到的现象是: _________________,产生该现象的化学方程式为:_____________________;
③取少量的碳铵和熟石灰粉末放入装置A的试管中,微热片刻立即移开酒精灯,将产生的氨气缓缓通入酚酞试液中,酚酞试液变红,证明氨气易溶于水,其水溶液显__________性(填“酸”或“碱”),pH__________7(填“>”、“=”或“<”);
④实验室收集氨气,应选用的一种装置是__________。根据你所选择的装置,回答以下对应的一个题目:
如果你选C装置,气体应从__________端导管通入;
如果你选D或E装置,则烧杯中的试剂是__________(填名称)。
23.(12分)化学反应往往伴随着一些现象发生,但CO2与NaOH溶液的反应没有明显的现象。为了通过一些现象说明CO2与NaOH发生了反应,某班同学分两组作了如下探究实验:
(1)第一组同学把一支收集有CO2的试管倒立在装有饱和NaOH溶液的烧杯中,如下图(1)所示,看到试管内液面上升。这种现象是因为试管内外产生
A.温度差 B.重力差 C.压强差 D.浮力差
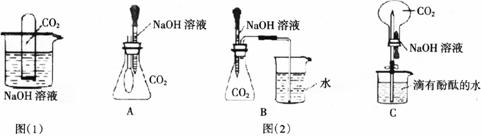
(2)第二组同学从中得到启发,也设计了如上图(2)实验装置进行探究:A现象为______,B现象为__________,C现象为__________。你认为以上设计能达到实验要求的是__________(填序号)。
(3)同学们经过分析讨论,认为第一组的实验中产生液面上升现象的原因可能有两种。一种是因为CO2与溶液中的NaOH反应,消耗了CO2,你认为另一种原因是___________。
(4)为了进一步证实CO2与NaOH溶液已经发生了反应,他们设计了如下方案:取上述实验后的溶液,第一组同学滴加_____,现象为_____________;第二组同学滴加__________,现象为_______________。他们虽然看到的现象不同,但都可以证实CO2与NaOH溶液已经发生了反应。
五、计算题(本大题2小题,共14分)
24.(6分)蛋白质是重要的营养物质,它由多种氨基酸(如丙氨酸、甘氨酸等)构成,甘氨酸的化学式为H2N―CH2―COOH。请回答下列问题:
(1)甘氨酸中碳、氢、氮、氧元素的质量比为__________。
(2)甘氨酸中碳元素的质量分数为__________。
(3)每克蛋白质完全氧化约放出18kJ的能量,成人每天摄取60~709的蛋白质,若有10%的蛋白质完全氧化,则放出的能量约为__________kJ。
25.(8分)小芳为测定VC药片中维生素C(化学式为C6H8O6)的质量分数,进行如下实验:
反应原理: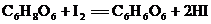 (I2不和VC药片中的其他成分反应)
(I2不和VC药片中的其他成分反应)
实验数据:取VC药片
请你帮助小芳计算:
(1)该VC药片中维生素C的质量。
(2)该VC药片中维生素C的质量分数。