2008-2009学年度潍坊市昌邑初中学段第一学期九年级期末考试
化学试卷
(时间90分钟,满分100分)
可能用到的相对原子质量:H
一、选择题(本题包括20小题,每小题2分,共40分。每小题只有一个答案正确,多选、错选均不得分)
1.2008年北京奥运会吉祥物-“福娃”向世界传递着友谊、和平、积极进取的精神。为儿童安全考虑,有一种“福娃”的外用材料为纯羊毛线,内充物为无毒的聚酯纤维。下列说法正确的是( )

A.羊毛的主要成分为纤维素
B.这种“福娃”不宜用碱性强的洗涤剂清洗
C.聚酯纤维是天然材料
D.不可以用燃烧的方法区分羊毛和聚酯纤雄
2.下列各项活动①工业废气排放到空气中 ②人、动植物的呼吸 ③喷洒农药 ④绿色植物的光合作用,后果对环境都没有危害的是( )
A.②③④ B.①②④ C.①③④ D.②④
3.园林工人常在树干下部涂上一层石灰浆,其作用是( )
A.美观 B.杀菌 C.标记 D.以上都不对
4.不会加剧酸雨、臭氧层空洞、温室效应等环境问题的是( )
A.使用太阳能热水器 B.燃烧煤
C.超音速飞机排放尾气 D.使用氟里昂做制冷剂
5.下列叙述中,正确的是( )
A.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液。
B.不饱和溶液转化为饱和溶液,其溶质质量分数一定增加
C.饱和溶液析出晶体后,溶质的质量分数一定变小
D.降低温度,饱和溶液可能不析出晶体
6.各种洗涤剂广泛进入人们的生活中,下列洗涤中所用洗涤剂具有乳化功能的是( )
A.用汽油除去衣服上的油污 B.用餐具洗洁精清洗餐具上的油污
C.用水洗去盘子中的水果渣 D.用醋洗去水壶的水垢
7.
A.该溶液中溶质的质量等于
C.该溶液中溶质的质量分数等于36% D.加水后该溶液变为不饱和溶液
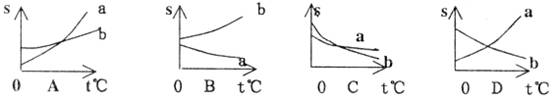
8.在室温下,两种物质a、b的饱和溶液,升高温度后,a溶液有晶体析出,而b溶液还可溶解晶体,下列能正确表示两物质溶解度(s)曲线的是( )
9.毒品有害人类健康,危害社会稳定。“摇头丸”是国家严令禁止的毒品之一,其化学式为C9H13N。有关该物质的下列说法中,不正确的是( )
A.组成物质各元素的质量比为9:13:1 B.该物质的相对分子质量为135
C.该物质是由三种元素组成的 D.该物质是属于有机物
10.下列化学方程式与事实相符的是( )
A.用胃舒乳[Mg(OH)2]治疗胃酸过多:Mg(OH)2+H2SO4=MgSO4+2H2O
B.实验室制备氧气:2H2O2=2H2O+O2↑
C.用盐酸除铁锈:FeO+2HCI=FeCl2+H2O
D.绿色植物的光合作用:6CO2+6H2O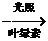 C6H12O6+6O2
C6H12O6+6O2
11.下列属于糖类的是( )
A.维生素 B.蛋白质 C.纤维素 D.酶
12.下列有关油脂的说法不正确的是( )
A.油脂的组成元素和淀粉相同,但结构不同,所以性质不同
B.油脂的组成和结构与淀粉相似,所以性质相同
C.油脂是人类膳食的重要组成部分,也是重要的营养物质
D.人体中的油脂还是维持生命活动的一种备用能源
13.下列说法中没有科学依据的是( )
A.维生素可以起到调节新陈代谢,预防疾病和维持身体健康的作用
B.人们在口中咀嚼馒头时会感到有甜味,因为淀粉是一种有甜味的有机物
C.酶是一种蛋白质,是生物催化剂,各种酶的催化作用具有很强的专一性
D.人体所需的大多数维生素都不能在体内合成,所以必须从食物中摄取
14.某金属R与硝酸银溶液反应的化学方程式为R+2AgNO3―R(NO3)2+2Ag,R与硝酸铜溶液不反应。关于R的推断正确的是( )
A.R能置换出酸中的氢 B.R的活动性介于铜、银之间
C.R的活动性比铜强,比银弱 D.R的活动性比铜、银都弱
15.将某盐酸与氢氧化钠溶液混合后,向其中滴加紫色石蕊试液,溶液变红。下列说法不正确的是( )
A.混合后溶液的pH<7
B.混合后的溶液为氯化钠溶液
C.混合后溶液的质量是混合前两种溶液的质量之和
D.混合后溶液中水的质量大于混合前两种溶液中水的质量之和
16.我们学习过以下常见的酸、碱、盐:HCl、H2SO4、NaOH、Ca(OH)2、Na2CO3、NaCl,请你整理归纳,这六种物质两两相互作用能发生化学反应共有( )
A.7个 B.6个 C.5个 D.4个
17.实验室制备FeCl3有多种方法,其中不可行的是
A.Fe2O3+6HCl==2FeCl3+3H2O
B.Fe(OH)3+3HCl ==FeCl3+3H2O
C.Fe2(SO4)3+3BaCl2==2FeCl3十3BaSO4↓
D.2Fe+6HCl==2FeCl3+3H2↑
18.把铁片放入下列各物质的稀溶液中片刻后取出,溶液质量增加的( )
A.CuSO4 B.MgCl
19.只用一种物质一次就能将稀硫酸、水、澄清石灰水三种无色液体鉴别出来,可供选用的物质是:①PH试纸、②酚酞试液、③稀盐酸、④碳酸钠溶液、⑤石蕊试液,其中能用鉴别的是( )
A.①④⑤ B.①②⑤ C.①②③ D.③④⑤
20.下列括号中的物质是除去杂质所用的试剂,其中错误的是
A.NaCl溶液中混有Na2CO3(盐酸)
B.NaOH溶液中含少量Na2CO3(澄清石灰水)
C.CO2气体中含有少量HCl(浓碱溶液)
D.NaCl溶液中含有少量NaSO4 (氯化钡溶液)
二、填空与简答题(每空1分,共30分)
21.(5分)2007年6月9日,“八国集团首脑会议”一至同意减少温室气体的排放。请根据图回答:
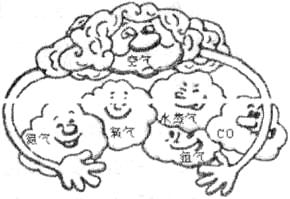
(1)在物质分类中空气属于____________。
(2)用化学式填空:制造化肥并还可以做保护气的是______;能供给人类呼吸的是________;上述“温室气体”是指____________;温室气体增多的主要原因是__________________。
22.(8分)依据所学的化学知识回答:
(1)下列措施错误的是____________(填序号):①油锅不慎着火,立即盖上锅盖;②酸或碱溶液溅入眼睛里,立即用大量水冲洗;③室内着火时用湿毛巾捂住口鼻、匍匐前进寻找出口;④用生石灰处理被酸污染的河水;⑤室内煤气泄漏,立即关闭煤气瓶阀、并打电话报警。
(2)未成熟水果含鞣酸而具有涩味,脱涩的方法之一是用石灰水浸泡水果。则用生石灰制成石灰水的化学方程式为______________________________
(3)稀释浓硫酸时,一定要把____________沿容器壁慢慢注入____________中,并不断搅拌,其原因是_________________________ _____________________________。
(4)2007年6月5日,在“南海一号”打捞出的文物中,“鎏金龙纹金手镯”光彩夺目、完好无损;铜镜表面有铜锈;铁器则锈迹斑斑或荡然无存。这说明金、铜、铁这三种金属的活动性从强到弱的顺序是(填元素符号) ____________;以下措施不能阻止铁器生锈的是(填序号) ____________:①喷漆、②刷搪瓷、③水洗、④镀一层耐腐蚀金属。
23.(4分)丙氨酸(C3H7O2N)是一种氨基酸,回答下列问题:
(1)每个丙氨酸分子中共含有____________个原子,其相对分子质量是____________;
(2)丙氨酸中各元素的质量比是____________;
(3)丙氨酸中氮元素的质量分数是____________。
24.(5分)2005年国家质监局发布公告:禁止生产或进口有害的DEHA(C22H42O4)增塑剂的PVC食品保鲜膜。市场上保鲜膜的种类较多,要保证食品安全,必须注意识别。
(1)DEHA由__________种元素组成,分子中C、H原子个数比为___________。DEHA是一种____________ (填“有机物”或“无机物”),使用不当易通过食物进入人体。
(2)塑料保鲜膜不宜包装热的油炸食品,因为高温时保鲜膜中增塑剂分子更容易从保鲜膜进入食品中。从微观角度解释其原因是__________________。
(3)全世界每年生产、使用约上千万吨保鲜膜,使用后成为塑料垃圾,为了保护环境,你提出的一条合理化建议是______________________________。
25.(4分)甲和乙两种物质的溶解度曲线如图所示:
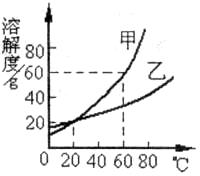
(1)20℃时,甲物质的溶解度___________ (填“大于”、“等于”或“小于”)乙物质的溶解度;
(2)60℃时,在100g水中加入80g甲固体,充分搅拌所得溶液的质量分数是____________。
(3)80℃时,某溶液所溶解的甲和乙物质都已饱和。把该溶液冷却到室温,有晶体析出,经检验发现析出的晶体主要是甲,其原因是___________ (填编号)
①80℃时,甲的溶解度更大 ②80℃时,乙的溶解度更大
③甲的溶解度受温度变化的影响比乙大
(4)若有一甲的溶液中混有少量乙要提纯甲可采用____________方法。
26.(4分)从A~D中选择正确的序号,填空(1)-(4)题。
A.加适量稀盐酸,搅拌、蒸发、结晶 B.加适量稀盐酸,搅拌、过滤、洗涤
C.加适量水,溶解、过滤、蒸发、结晶 D.加适量水,溶解、过滤、洗涤
(1)提纯含有少量泥沙的粗盐________________________;
(2)从草木灰中提取碳酸钾________________________;
(3)除去氯化钠中的少量碳酸钠________________________;
(4)实验室常用加热氯酸钾与二氧化锰的混合物来制取氧气,有关反应的化学方程式为
2KClO3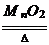 2KCl+3O2↑,从反应后的残渣中回收二氧化猛(MnO2不溶于水) __________.
2KCl+3O2↑,从反应后的残渣中回收二氧化猛(MnO2不溶于水) __________.
三、实验及探究题(每空1分,共19分)
27.(9分)已知干燥剂“碱石灰”的成份是:CaO和NaOH,在潮湿的空气中极易变质。某小组的同学对实验室中一瓶放置已久的“碱石灰”进行了如下的探究:
(1)甲同学猜想:样品只与空气中的水蒸汽发生了作用。则NaOH会________________;CaO会变质,其反应的类型为__________________反应。
(2)乙同学猜想:(请将表格填写完整)
猜 想
实验设计
现象
判断
猜想a
样品含碳酸盐
取少量样品,滴加盐酸
无气泡放出
猜想b
样品中含有Na2CO3,且还含有CaO、Ca(OH)2、CaCO3中的一种
取少量溶于水,过滤,在滤液中滴入稀盐酸
猜想b成立
(3)丙同学进行了如下图所示的实验:
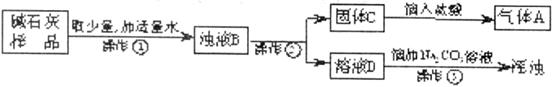
图中操作①、②都要用到玻璃棒,其中操作①玻璃棒的作用是______________________;从操作③的现象分析,溶液D中含有的物质是____________;写出溶液D与Na2CO3溶液反应的化学方程式__________________________,反应类型为_______________。
28.(4分)某学生为了证明某白色固体是硫酸铵,他设计了两步程序:
(1)第一步:为了证明NH4+的存在,必须的操作步骤是_______________________________,当观察到______________________________的现象时,证明有NH4+存在。
(2)第二步:为了证明SO42-的存在,该学生设计了三种方案:①加入BaCl2溶液,再加稀盐酸;②加入过量盐酸化了的BaCl2溶液;③先加过量盐酸酸化,再加BaCl2溶液。你认为上述三种方案中最合理的一种方案是____________________,简述合理的理由____________ ___________________________________。
29.(6分)
【实验探究】氢氧化钠溶液中哪一种粒子(H2O、Na+、OH-)能使指示剂变色。
【实验步骤】
(1)在第一支试管中加入约2mL蒸馏水,滴入几滴无色酚酞试液,观察现象。
(2)在第二支试管中加入约2mLNaCl(pH=7)溶液,滴入几滴无色酚酞试液,观察现象。
(3)在第三支试管中加入约2mLNaOH溶液,滴入几滴无色酚酞试液,观察现象。
通过上述实验探究,回答下列问题:
实验(1)看到的现象是___________________,你得到的结论是_________________________;
实验(2)看到的现象是___________________,你得到的结论是_________________________;
实验(3)看到的现象是___________________,你得到的结论是_________________________;
四、计算题(11分)
某化工厂制得的纯碱(Na2CO3)中含有少量氯化钠。现取某种仅含氯化钠杂质的纯碱样品11.1g,全部溶解在120g水中,再加入氯化钡溶液144g,恰好完全反应并生成碳酸钡沉淀。过滤干燥后,称得沉淀质量为19.7g。
求:1.纯碱样品中Na2CO3的质量。
2.滤液中溶质的质量分数。